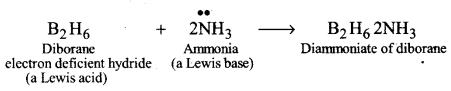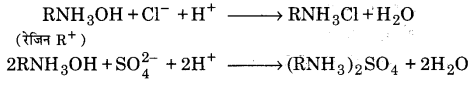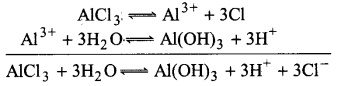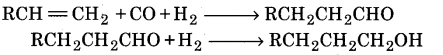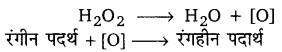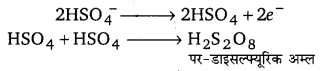UP Board Solutions for Class 11 Chemistry Chapter 9 Hydrogen (हाइड्रोजन)
These Solutions are part of UP Board Solutions for Class 11 Chemistry. Here we have given UP Board Solutions for Class 11 Chemistry Chapter 9 Hydrogen (हाइड्रोजन).
पाठ के अन्तर्गत दिए गए प्रश्नोत्तर
प्रश्न 1.
हाइड्रोजन के इलेक्ट्रॉनिक विन्यास के आधार पर आवर्त सारणी में इसकी स्थिति को युक्तिसंगत ठहराइए। हल उत्तर
उत्तर
हाइड्रोजन एक विशिष्ट तत्व है, जो आवर्त सारणी के वर्ग 1 की क्षार धातुओं तथा वर्ग 17 के हैलोजेन गैसों के गुण प्रदर्शित करता है। इस दोहरे गुण के कारण हाइड्रोजन की आवर्त सारणी में स्थिति विवादास्पद बनी हुई है।
हाइड्रोजन के दोहरे व्यवहार का कारण इसका इलेक्ट्रॉनिक विन्यास है। हाइड्रोजन s-ब्लॉक की प्रथम तत्व है। इसका इलेक्ट्रॉनिक विन्यास 1s’ है अर्थात् हाइड्रोजन परमाणु के बाहरी कोश, जो पहला कोश भी है, में केवल एक इलेक्ट्रॉन है। हाइड्रोजन एक इलेक्ट्रॉन त्यागकर H+ आयन या धनायन अर्थात् प्रोटॉन दे सकता है और एक इलेक्ट्रॉन ग्रहण करके H– आयन या ऋणायन बना सकता है।

हाइड्रोजन के सन्दर्भ में उपर्युक्त तथ्य से आवर्त सारणी में इसकी स्थिति निम्नलिखित बिन्दुओं से समझी जा सकती है-
हाइड्रोजन की क्षार धातुओं (वर्ग 1 के तत्वों से समानता
(Similarities of Hydrogen with Alkali Metals)
(i) इलेक्ट्रॉनिक विन्यास (Electronic configuration)–इलेक्ट्रॉनिक विन्यास समान है और इनके अन्तिम कोश में एक इलेक्ट्रॉन s-1 है।
1H = 1s1 11Na = 1s2,2s2 2p6,3s1
(ii) विद्युत-धनात्मक गुण (Electropositive character)–एक इलेक्ट्रॉन त्यागकर धनायन देते हैं।
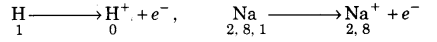
इस व्यवहार को इस तथ्य से प्रबल समर्थन मिलता है कि जब अम्लीकृत जल को विद्युत-अपघटन किया जाता है तो कैथोड पर हाइड्रोजन मुक्त होती है। इसी प्रकार गलित सोडियम क्लोराइड के विद्युत अपघटन पर कैथोड पर सोडियम, (क्षार धातु) मुक्त होती है।
(iii) ऑक्सीकरण अवस्था (Oxidation state) हाइड्रोजन तथा क्षार धातु अपने यौगिकों में +1 ऑक्सीकरण अवस्था दर्शाते हैं। उदाहरणार्थ-HCl, NaCl आदि।
(iv) रासायनिक बन्धुता (Chemical affinity)-हाइड्रोजन तथा क्षार धातुएँ विद्युत धनात्मक प्रकृति के होते हैं। अतः इनमें विद्युत-ऋणी तत्वों के प्रति बन्धुता पाई जाती है अर्थात् ये तीव्रता से इनके साथ संयोग करते हैं। उदाहरणार्थ-
सोडियम के यौगिक – Na2P, NaCl, Na2S
हाइड्रोजन के यौगिक – H2O2 HCl, H2S
(v) अपचायक प्रकृति (Reducing nature)-हाइड्रोजन तथा अन्य क्षार धातु वर्ग के सदस्य प्रबल अपचायक होते हैं; क्योंकि वे उनके यौगिकों से ऑक्सीजन को हटाते हैं। उदाहरणार्थ-


क्षार धातुओं से असमानता (Dis-similarities with Alkali Metals)
हाइड्रोजन क्षार धातुओं से भिन्नता भी दर्शाता है। इनका वर्णन निम्नवत है-
- क्षार धातुएँ प्रारूपिक धातुएँ (typical metals) होती हैं, जबकि हाइड्रोजन एक अधातु है।
- हाइड्रोजन द्विपरमाणुक (diatomic) होती है, जबकि क्षार धातुएँ एकपरमाणुक होती हैं।
- क्षार धातुओं की आयनन ऊर्जा (सोडियम की आयनन ऊर्जा = 496 kJ mol-1) हाइड्रोजन (1312 kJ mol-1) की तुलना में बहुत कम होती है।
- हाइड्रोजन के यौगिक सामान्यतः सहसंयोजक होते हैं (जैसे-HCI, H2O आदि), जबकि क्षार धातुओं के यौगिक सामान्यत: आयनिक होते हैं (जैसे-NaCI, KF आदि)।
हाइड्रोजन तथा हैलोजेन की समानता (Similarities of Hydrogen and Halogens)
(i) इलेक्ट्रॉनिक विन्यास (Electronic configuration)-इलेक्ट्रॉनिक विन्यास इस कारण से समान होते हैं कि इनके बाहरी कोश में अक्रिय गैस से एक इलेक्ट्रॉन कम होता है और ये एक इलेक्ट्रॉन ग्रहण करके अक्रिय गैस की स्थायी संरचना प्राप्त कर लेते हैं।

(ii) विद्युत-ऋणात्मक गुण (Electronegative character)–ये एक इलेक्ट्रॉन ग्रहण करके ऋणायन देते हैं।
H+ e– → H–, X+e– → X–, (X = हैलोजेन)
(iii) द्विपरमाणुक प्रकृति (Diatomic nature)-हाइड्रोजन तथा हैलोजेन दोनों द्वि-परमाणुक | अणु बनाते हैं जिसमें सहसंयोजक बन्ध होते हैं।
H — H या H2, Cl — Cl या Cl,
(iv) ऐनोड पर विमुक्ति (Liberation at anode)-हैलाइडों के जलीय विलयन विद्युत्-अपघटन पर ऐनोड पर ऋणायन देते हैं। इसी प्रकार NaH विद्युत्-अपघटन पर ऐनोड पर H आयन देता है।

(v) आयनन एन्थैल्पी (Ionisation enthalpy)-आयनन ऊर्जा लगभग समान होती है, किन्तु क्षार धातुओं से अधिक होती है।

(vi) ऑक्सीकरण अवस्था (Oxidation state)-हैलोजेन यौगिकों में -1 ऑक्सीकरण अवस्था दर्शाते हैं तथा हाइड्रोजन भी अपने यौगिकों में ( धातुओं के साथ) -1 ऑक्सीकरण अवस्था । दर्शाता है।
उदाहरणार्थ-Na+H– तथा Na+F– ।
(vii) अधात्विक प्रकृति (Non-metallic nature)–हाइड्रोजन तथा हैलोजेनों का सबसे महत्त्वपूर्ण सामान्य गुण अधात्विक प्रकृति है। दोनों प्रारूपिक अधातु हैं। (viii) यौगिकों की प्रकृति (Nature of compounds)-हाइड्रोजन तथा हैलोजेन के अनेक यौगिक सहसंयोजी प्रकृति के होते हैं। उदाहरणार्थ-
हाइड्रोजन के सहसंयोजक यौगिक – CH4, SiH4, GeH4
क्लोरीन के सहसंयोजक यौगिक – CCl4, SiCl4, GeCl4
यहाँ यह तथ्य महत्त्वपूर्ण है कि हाइड्रोजन तथा हैलोजेन परमाणु परस्पर सरलता से प्रतिस्थापित किए जा सकते हैं।

हैलोजेनों से असमानता (Dis-similarities with Halogens)
निम्नलिखित गुणधर्मों में हाइड्रोजन हैलोजेनों से भिन्नता रखता है-
- हैलोजेन तीव्रता से हैलाइड आयन (X–) बना लेते हैं, परन्तु हाइड्रोजन केवल क्षार तथा क्षारीय | मृदा धातुओं के साथ यौगिकों में हाइड्राइड आयन (H–) बनाता है।
- आण्विक रूप में, H परमाणुओं पर एकाकी इलेक्ट्रॉन युग्म नहीं होता, जबकि X परमाणुओं . पर ऐसे तीन युग्म होते हैं। उदाहरणार्थ-

- हैलोजेन के ऑक्साइड सामान्यतया अम्लीय होते हैं, जबकि हाइड्रोजन के ऑक्साइड उदासीन होते हैं।
निष्कर्षन-हाइड्रोजन दोनों समूहों के साथ समान लक्षण रखता है। अत: इसे आवर्त सारणी में एक निश्चित स्थान देना कठिनाई का विषय है। चूंकि तत्वों के आवर्ती वर्गीकरण का आधार इलेक्ट्रॉनिक विन्यास है; अतः हाइड्रोजन को क्षार धातुओं के साथ वर्ग 1 में सबसे ऊपर रखा गया है, परन्तु हाइड्रोजन की यह स्थिति पूर्ण रूप से न्यायोचित नहीं है।
प्रश्न 2.
हाइड्रोजन के समस्थानिकों के नाम लिखिए तथा बताइए कि इन समस्थानिकों का द्रव्यमान अनुपात क्या है?
उत्तर
हाइड्रोजन तीन समस्थानिकों के रूपों में पाया जाता है। इनके नाम प्रोटियम (11H), ड्यूटीरियम (12H) तथा ट्राइटियम (13H) हैं। इन समस्थानिकों का द्रव्यमान अनुपात निम्नवत् है-
11H :12H :13H :: 1.008 : 2.014 : 3.016
प्रश्न 3.
सामान्य परिस्थितियों में हाइड्रोजन एकपरमाण्विक की अपेक्षा द्विपरमाण्विक रूप में क्यों पाया जाता है?
उत्तर
हाइड्रोजन का इलेक्ट्रॉनिक विन्यास 1s1 है। इसमें He (Helium) की भाँति स्थायी इलेक्ट्रॉनिक विन्यास प्राप्त करने के लिये एक इलेक्ट्रॉन की कमी होती है। इसलिए, यह He की भाँति स्थायी इलेक्ट्रॉनिक विन्यास प्राप्त करने के लिये दूसरे हाइड्रोजन परमाणु से एक इलेक्ट्रॉन का साझा करती है। तथा द्विपरमाणविक H2 (H—H) अणु बनाती है।
प्रश्न 4.
‘कोलगैसीकरण से प्राप्त डाइहाइड्रोजन का उत्पादन कैसे बढ़ाया जा सकता है?
उत्तर
कोलगैसीकरण, वह प्रक्रिया है जिसमें रक्त तप्त कोयले की अभिक्रिया 1270 K पर जल भाप से (Bosch Process) की जाती है।

Syngas (water gas) Syngas मिश्रण में उपस्थित कार्बन मोनोऑक्साइड से जल वाष्प की अभिक्रिया कर H2 का उत्पादन बढ़ाया जा सकता है। इसमें FeCrO4 उत्प्रेरक की भाँति कार्य करता है।

यह water gas shift reaction कहलाती है। मिश्रण से कार्बन डाइऑक्साइड को सोडियम आर्सेनाइट विलयन में प्रवाहित कर अलग किया जा सकता है।
प्रश्न 5.
विद्युत-अपघटन विधि द्वारा डाइहाइड्रोजन वृहद् स्तर पर किस प्रकार बनाई जा सकती है? इस प्रक्रम में विद्युत-अपघट्य की क्या भूमिका है?
उत्तर
विद्युत-अपघटन विधि द्वारा डाइहाइड्रोजन का निर्माण (Formation of Dihydrogen by electrolytic process)—सर्वप्रथम शुद्ध जल में अम्ल तथा क्षारक की कुछ बूंदें मिलाकर इसे विद्युत का सुचालक बना लेते हैं। अब इसका विद्युत-अपघटन (वोल्टामीटर में) करते हैं। जल के विद्युत-अपघटन से ऋणोद (कैथोड) पर डाइहाइड्रोजन और धनोद (ऐनोड) पर ऑक्सीजन (सहउत्पाद के रूप में) एकत्रित होती है। ऐनोड तथा कैथोड को एक ऐस्बेस्ट्स डायफ्राम की सहायता से पृथक्कृत कर दिया जाता है जो मुक्त होने वाली हाइड्रोजन तथा ऑक्सीजन को मिश्रित नहीं होने देता।

इस प्रकार प्राप्त डाइहाइड्रोजन पर्याप्त रूप से शुद्ध होती है।
विद्युत-अपघट्य की भूमिका (Role of electrolyte)– शुद्ध जल विद्युत-अपघट्य नहीं होता और न ही विद्युत का चालक होता है। शुद्ध जल में अम्ल या क्षार की कुछ मात्रा मिलाकर इसे , विद्युत अपघट्य बनाया जाता है।
प्रश्न 6.
निम्नलिखित समीकरणों को पूरा कीजिए-


उत्तर

प्रश्न 7.
डाइहाइड्रोजन की अभिक्रियाशीलता के पदों में H — H बन्ध की उच्च एन्थैल्पी के परिणामों की विवेचना कीजिए।
उत्तर
H—H बन्ध की उच्च एंथैल्पी (435.88 kJ mol-1) के कारण, डाइहाड्रोजन सामान्य तापमान पर अधिक क्रियाशील नहीं है। लेकिन उच्च ताप अथवा उत्प्रेरक की उपस्थिति में यह अधिक क्रियाशील हो जाती है तथा अनेक तत्त्वों के साथ बड़ी संख्या में यौगिकों का निर्माण करती है।
प्रश्न 8.
हाइड्रोजन के
(i) इलेक्ट्रॉन न्यून,
(ii) इलेक्ट्रॉन परिशुद्ध तथा
(iii) इलेक्ट्रॉन समृद्ध
यौगिकों से आप क्या समझते हैं। उदाहरणों द्वारा समझाइए।
उत्तर
हाइड्रोजन के जिन यौगिकों में पारम्परिक लूइस संरचना के लिये आवश्यक इलेक्ट्रॉनों से कम इलेक्ट्रॉन उपस्थित होते हैं, उन्हें इलेक्ट्रॉन न्यून यौगिक कहा जाता है, जैसे-B2H6। जिन यौगिकों में पारम्परिक लूइस संरचना के अनुरूप पर्याप्त इलेक्ट्रॉन होते हैं, उन्हें इलेक्ट्रॉन परिशुद्ध यौगिक कहा जाता है, जैसे-CH4,C2H4Si2H6 आदि। जिन यौगिकों में एकल युग्मों के रूप में इलेक्ट्रॉन उपस्थित होते हैं, उन्हें इलेक्ट्रॉन समृद्ध यौगिक कहा जाता है, जैसे- आदि।
आदि।
प्रश्न 9.
संरचना एवं रासायनिक अभिक्रियाओं के आधार पर बताइए कि इलेक्ट्रॉन न्यून हाइड्राइड के कौन-कौन से अभिलक्षण होते हैं?
उत्तर
(i) इलेक्ट्रॉन न्यून हाइड्रोइड (electron-deficient hydrides) के पास इतने इलेक्ट्रॉन नहीं होते कि वह सामान्य सहसंयोजक (covalent bond) बना सकें। इसलिए, इलेक्ट्रॉन की कमी को पूरी करने के लिये ये बहुलक अवस्था में पाये जाते हैं, जैसे -B2H6 B4H10,(AlH3 )n इत्यादि।
(ii) इलेक्ट्रॉनों की कमी के कारण, इलेक्ट्रॉन न्यून हाइड्राइड लूइस अम्लों की तरह व्यवहार करते हैं और लूइस बेस के साथ जटिलों (complexes) को निर्माण करते हैं। जैसे-
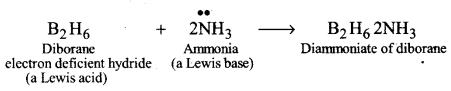
(iii) इलेक्ट्रॉनों की कमी के कारण, इलेक्ट्रॉन न्यून हाइड्राइड बहुत अधिक अभिक्रियाशील होते हैं। और अनेक धातुओं, अधातुओं और यौगिकों के साथ अभिक्रिया करते हैं। जैसे,

प्रश्न 10.
क्या आप आशा करते हैं कि (CnH2n+2) कार्बनिक हाइड्राइड लूइस अम्ल या क्षार की भॉतिं कार्य करेंगे? अपने उत्तर को युक्तिसंगत ठहराइए।
उत्तर
नहीं, कार्बन के CnH2n+2 प्रकार के हाइड्राइड लूइस अम्ल या लूइस बेस की भाँति कार्य नहीं करते। ऐसा इसलिये होता है, क्योंकि इनमें आवश्यक सहसंयोजक बन्ध बनाने के लिए सही संख्या में इलेक्ट्रॉन उपस्थित होते हैं। अतः इनमें न तो इलेक्ट्रॉन की कमी होती है और न ही एकल युग्म के रूप में इलेक्ट्रॉन की अधिकता। इसलिए ये लूइस अम्ल व लूइस बेस की तरह व्यवहार नहीं करते।
प्रश्न 11.
अरससमीकरणमितीय हाइड्राइड (non-stoichiometric hydride) से आप क्या समझते हैं? क्या आप क्षारीय धातुओं से ऐसे यौगिकों की आशा करते हैं? अपने उत्तर को न्यायसंगत ठहराइए।
उत्तर
वह हाइड्राइड जिसमें धातु और हाइड्रोजन का अनुपात भिन्नात्मक होता है, अरससमीकरणमितीय हाइड्राइड कहलाता है। क्षार धातु अरससमीकरणमितीय हाइड्राइड नहीं बनाते। क्षार धातुओं के संयोजी कोश में केवल एक इलेक्ट्रॉन होता है। हाइड्राइड के निर्माण के समय, क्षार धातु अपना संयोजी (valence) इलेक्ट्रॉन जुड़ने वाले H परमाणु (approching Hatom) को दे देता है। जिसमें H परमाणु H– आयन में बदल जाता है और क्षार धातु एक धन आवेश युक्त धनायन बनाती है। इसलिए, जो हाइड्राइड क्षार धातुओं द्वारा बनाये जाते हैं वे आयनिक होते हैं। चूंकि H– आयन का निर्माण इलेक्ट्रॉन के क्षार धातु से हाइड्रोजन परमाणु पर पूर्ण स्थानान्तरण द्वारा होता है, इस कारण निर्मित हाइड्राइड हमेशा अरसमीकरणमितीय होगा, अर्थात् धातु तथा हाइड्रोजन का अनुपात हमेशा निश्चित होगा। इसी कारण क्षार धातु से बने हाइड्राइड हमेशा सूसमीकरणमितीय (stoichiometric) होते हैं।
प्रश्न 12.
हाइड्रोजन भण्डारण के लिए धात्विक हाइड्राइड किस प्रकार उपयोगी है? समझाइए।
उत्तर
धातु हाइड्राइडों विशेष रूप से Ni, Pd, Ce तथा Ac के हाइड्राईडों में हाइड्रोजन धातु जालक के छिद्रों (interstices) में समा जाती है। Pd, Pt आदि धातु काफी अधिक मात्रा में हाइड्रोजन को समावेशित कर सकते हैं। इसलिये उनका उपयोग हाइड्रोजन के भण्डारण में किया जा सकता है।
प्रश्न 13.
कर्तन और वेल्डिंग में परमाण्वीय हाइड्रोजन अथवा ऑक्सी हाइड्रोजन टॉर्च किस प्रकार कार्य करती है? समझाइए।
उत्तर
(i) परमाण्वीय हाइड्रोजन टॉर्च में, दो टंगस्टन इलेक्ट्रॉड के बीच आण्विक हाइड्रोजन में विद्युत स्फुलिंग (विद्युत आर्क) प्रवाहित की जाती है। स्फुलिंग की ऊर्जा आण्विक हाइड्रोजन (H2) को परमाण्वीय हाइड्रोजन (H) में वियोजित कर देती है जैसा नीचे दिखाया गया है।

हाइड्रोजन परमाणु 0.3 सेकण्ड के पश्चात् आपस में जुड़कर H2 अणु का निर्माण करते हैं। इस प्रक्रिया में बहुत अधिक मात्रा में ऊष्मा (4300-5300 K) उत्पन्न होती है, जो कर्तन (cutting) और वेल्डिंग (welding) प्रक्रियाओं में उपयोग होती है। इस टार्च की विशेषता यह है कि H2 की उपस्थिति, के कारण धातु का ऑक्सीकरण नहीं होता।
(ii) ऑक्सी-हाइड्रोजन टार्च में, आणविक हाइड्रोजन (H2) को ऑक्सीजन की उपस्थिति में जलाया जाता है जिसके परिणामस्वरूप तीव्र गर्म ज्वाला (intensely hot flame) उत्पन्न होती है। इस टार्च का कर्तन (cutting) और वेल्डिंग (weldirag) प्रक्रियाओं में उपयोस होता है।
प्रश्न 14.
NH3, H2O तथा HF में से किसका काइड्रोजन बन्ध का घरिमण उच्चतम अपेक्षित है और क्यों?
उत्तर
HF का, क्योंकि F एक सर्वाधिक विद्युत ऋणात्मक (most electrenegative) तत्त्व है। उच्च विद्युत ऋणात्मकता (electronegativity) के कारण, यह H—F के साझे के इलेक्ट्रॉन को अपनी ओर आकर्षित कर लेता है जिससे H पर धनात्मक आवेश उत्पन्न हो जाता है जिसका परिमाण NH3 और H2O में उत्पन्न हुए आवेश से अधिक होता है।
प्रश्न 15.
लवणीय हाइड्राइड जल के साथ प्रबल अभिक्रिया करके आग उत्पन्न करती है। क्या इसमें CO2 (जो एक सुपरिचित अग्निशामक है) का उपयोग हम कर सकते हैं? समझाइए।
उत्तर
लवणीय हाइड्राइड (saline hydrides) पानी के साथ प्रबल रूप में अभिक्रिया करते हैं तथा डाइहाइड्रोजन (H2) उत्पन्न करता है जो आग पकड़ लेती है, जैसे-
NaH(s) + H2O(l) → NaOH(aq) + H2(g)
CaH2(s) + 2H2O(l) → Ca(OH)2(aq) + 2H2(g)
इस प्रकार उत्पन्न हुई आग CO2 (अग्निशामक) द्वारा नहीं बुझायी जा सकती क्योंकि CO2 धातु हाइड्राइड द्वारा अपचयित हो जाती है।
NaH+CO2 → HCOONa इस प्रकार की आग को बुझाने हेतु अग्निशामक (extinguish) के रूप में रेत (sand) का प्रयोग किया जा सकता है।
प्रश्न 16.
निम्नलिखित को व्यवस्थित कीजिए-
(i) CaH2, BeH2, तथा TiH2, को उनकी बढ़ती हुई विद्युतचालकता के क्रम में।
(ii) LiH, NaH तथा CsR को आयनिक गुण के बढ़ते हुए क्रम में।
(iii) H—H, D—D तथा F—F को उनके बन्ध-वियोजन एन्थैल्पी के बढ़ते हुए क्रम में।
(iv) NaH, MgH2 तथा H2O को बढ़ते हुए अपचायक गुण के क्रम में।
उत्तर
(i) BeH2 <CaH2 <TiH2
BeH2 एक सहसंयोजी हाइंड्राइड है जो विद्युत धारा प्रवाहित नहीं करता है। CaH2 संलयित , अवस्था में विद्युत चालक है जबकि TiH2 कमरे के ताप पर विद्युत का चालक है।
(ii) LiH<NaH<CsH
LiH आंशिक सहसंयोजक प्रवृत्ति का होता है और Na की विद्युत ऋणात्मकता Cs से अधिक है। अत: CsH में आयनिक गुण सबसे अधिक है, जबकि LiH में सबसे कम।
(iii) F—F<H—H<D—D
F2 में, F परमाणु के एकल इलेक्ट्रॉन युग्म तथा F—F आबन्ध के आबन्ध युग्म के बीच प्रतिकर्षण होता है। इसलिए F—F की बन्ध वियोजन एंथैल्पी सबसे कम होती है।

D परमाणु H परमाणु से छोटा है। इसलिए, D—D आबन्ध की आबन्ध वियोजन एंथैल्पी (bond dissociation enthalpy) सबसे अधिक होती है। (iv) H2O< MgH2 < NaH
H2O और MgH2 सहसंयोजक हाइड्राइड हैं। उच्च आबन्ध वियोजन ऊर्जा (high bond dissociation energy) के कारण H2O का अपचायक गुण MgH2 से कम है। NaH एक लवणीय हाइड्राइड (saline hydride) है और इसका अपचायक गुण H2O और MgH2 से अधिक है।
प्रश्न 17.
H2O तथा H2O2 की संरचनाओं की तुलना कीजिए।
उत्तर
जल-अणु की सरंचना (Structure of Water Molecule)-गैस-प्रावस्था में जल एक बंकित (bent) अणु है। आबन्ध कोण तथा O—H आबन्ध दूरी के मान क्रमशः 104.5° तथा 95.7 pm हैं, जैसा चित्र-2 (क) में प्रदर्शित किया गया है। अत्यधिक ध्रुवित अणु चित्र-2 (ख) में तथा चित्र-2 (ग) में जल के अणु में ऑर्बिटल अतिव्यापन दर्शाया गया है।

हाइड्रोजन परॉक्साइड अणु की संरचना (Structure of Hydrogen peroxide Molecule) हाइड्रोजन परॉक्साइड की संरचना असमतलीय (खुली पुस्तक के समान) होती है। गैसीय प्रावस्था तथा ठोस प्रावस्था में इसकी आण्विक संरचना को चित्र-3 में दर्शाया गया है।

प्रश्न 18.
जल के स्वतः प्रोटोनीकरण से आप क्या समझते हैं? इसका क्या महत्त्व है?
उत्तर
जल का स्वतः प्रोटोनीकरण वास्तव में इसका स्वत: आयनन है जो निम्न प्रकार से सम्पन्न होता है-

जल का स्वत: प्रोटोनीकरण जल को उभयधर्मी (amphoteric) बनाता है। इसलिए, जल अम्ल और क्षार दोनों की तरह क्रिया करता है।
जल अपने से प्रबल अम्ल के साथ अभिक्रिया करने पर क्षार की तरह व्यवहार करता है और अपने से प्रबल क्षार से अभिक्रिया करने पर अम्ल की तरह व्यवहार करता है। जैसे-

प्रश्न 19.
F2 के साथ जल की अभिक्रिया में ऑक्सीकरण तथा अपचयन के पदों पर विचार कीजिए एवं बताइए कि कौन-सी स्पीशीज ऑक्सीकृत/अपचयित होती है?
उत्तर

अतः इस अभिक्रिया में जल (water) अपचायक है क्योंकि यह ऑक्सीकृत होकर O2 देता है। F2 अपचयित होकर F– आयन देती है इसलिए यह ऑक्सीकारक है।
प्रश्न 20.
निम्नलिखित अभिक्रियाओं को पूर्ण कीजिए
(i) PbS(s) + H2O2(aq) →
(ii) MnO–4(aq) + H2O2(aq) →
(iii) CaO(s) + H2O(g) →
(iv) AlCl3(g) + H2O(l) →
(v) Ca3N2(s) + H2O(l) →
उपर्युक्त को
(क) जल-अपघटन,
(ख) अपचयोपचय (redox) तथा
(ग) जलयोजन
अभिक्रियाओं में वर्गीकृत कीजिए।
उत्तर
- PbS(s) + 4H2O2 (aq)- PbSO4 (s) +4H2O(l) (अपचयोपचय अभिक्रिया)
- 2MnO–4 (aq) + 5H2O2 (aq) + 6H+ (aq) → 2Mn2+ (aq) + 8H2O(l) + 5O2(g) (अपचयोपचय अभिक्रिया)
- CaO(s)+ H2O(g) + Ca(OH)2 (aq) (जलयोजन अभिक्रिया)
- AlCl3 (g) + 3H2O(7) → Al(OH)3 (s)+ 3HCl (aq) (जल-अपघटन अभिक्रिया)
- Ca3N2 (s) + 6H2O(l) → 3Ca(OH)2 (aq) + 2NH3 (aq) (जल-अपघटन अभिक्रिया)
प्रश्न 21.
बर्फ के साधारण रूप की संरचना का उल्लेख कीजिए।
उत्तर
बर्फ की संरचना (Structure of Ice)–बर्फ एक अतिव्यवस्थित, त्रिविम, हाइड्रोजन आबन्धित संरचना (highly ordered, three dimensional, hydrogen bonded structure) है जिसे निम्नांकित चित्र-4 में दर्शाया गया है।

X-किरणों द्वारा परीक्षण से पता चला है कि बर्फ क्रिस्टल में ऑक्सीजन परमाणु चार अन्य हाइड्रोजन परमाणुओं से 276 pm दूरी पर चतुष्फलकीय रूप से घिरा रहता है।
हाइड्रोजन आबन्ध बर्फ में वृहद् छिद्र (wide holes) एक प्रकार की खुली संरचना बनाते हैं। ये छिद्र . उपयुक्त आकार के कुछ दूसरे अणुओं को अन्तराकाश में ग्रहण कर सकते हैं।
उपर्युक्त चित्र में दर्शाई बर्फ की संरचना से स्पष्ट है कि प्रत्येक ऑक्सीजन परमाणु चार हाइड्रोजन परमाणुओं से घिरा हुआ है जिनमें दो प्रबल सहसंयोजी आबन्ध (ठोस रेखा द्वारा प्रदर्शित) से तथा दो दुर्बल हाइड्रोजन आबन्धों (बिन्दुदार रेखा से प्रदर्शित) से जुड़े हुए हैं। चूंकि हाइड्रोजन बन्ध (177 pm) सहसंयोजी आबन्धों (95.7 pm) से लम्बे हैं; अतः जल-अणु क्रिस्टल जालक में निविड-संकुलित (closely packed) नहीं होते।
प्रश्न 22.
जल की अस्थायी एवं स्थायी कठोरता के क्या कारण हैं? वर्णन कीजिए।
उत्तर
अस्थायी कठोरता (Temporary hardness)-अस्थायी कठोरता जल में कैल्सियम तथा मैग्नीशियम के हाइड्रोजन कार्बोनेट की उपस्थिति के कारण होती है। इसे उबालकर दूर किया जा सकता है। स्थायी कठोरता (Permanent hardness)-स्थायी कठोरता जल में विलेयशील कैल्सियम तथा मैग्नीशियम के क्लोराइड तथा सल्फेट के रूप में घुले रहने के कारण होती है। यह उबालने से दूर नहीं की जा सकती है।
प्रश्न 23.
संश्लेषित आयन विनिमयक विधि द्वारा कठोर जल के मृदुकरण के सिद्धान्त एवं विधि की विवेचना कीजिए।
उत्तर
संश्लेषित आयन विनिर्मयक विधि (Synthetic lon-Exchange Method) संश्लेषित आयन विनिमयक विधि द्वारा जल में विद्यमान कठोरता के लिए उत्तरदायी आयनों को उन अन्य आयनों द्वारा प्रतिस्थापित कर दिया जाता है जो जल की कठोरता के लिए उत्तरदायी नहीं होते। इस विधि में दो प्रकार के आयन विनिमयक प्रयोग किए जाते हैं–
- अकार्बनिक आयन विनिमयक तथा
- कार्बनिक आयन विनिमयक।।
1. अकार्बनिक आयन विनिमयक : परम्यूटिट विधि (Inorganic lon-Exchanger : Permutit Method)
इस विधि को ‘जियोलाइट/परम्यूटिट विधि’ भी कहते हैं। यह व्यापारिक मात्रा में कठोर जल को मृदु करने की विधि है। इस विधि में सोडियम जियोलाइट का प्रयोग किया जाता है। यह वास्तव में सोडियम ऐलुमिनियम सिलिकेट नामक पदार्थ है। इसका सूत्र Na2 Al2pSi2O8 है। यह या तो प्राकृतिक रूप से प्राप्त होता है अथवा इसे सोडे की राख (Na2CO3), सिलिका (SiO2) तथा ऐलुमिना (Al2O3) के मिश्रण से कृत्रिम रूप से बनाया जा सकता है। इस मिश्रण के संगलित पदार्थ को जल से धोकर शेष बचे छिद्रित पदार्थ को ही परम्यूटिट कहते हैं। सरलता की दृष्टि से ऐलुमिनियम सिलिकेट अथवा जियोलाइट आयन (Al2Si2O8) के स्थान पर ‘Z’ लिखकर सोडियम जियोलाइट को Na2Z सूत्र द्वारा प्रदर्शित किया जाता है। परम्यूटिट विधि से दोनों प्रकार की कठोरता दूर कर सकते हैं। सोडियम जियोलाइट में उपस्थित सोडियम लवणों का यह गुण है कि ये अन्य आयनों द्वारा विस्थापित हो जाते हैं।
परम्युटिट को एक विशेष बेलनाकार पात्र में रखते हैं जिसमें मोटी रेत तथा परम्यूटिट भरा होता है। कठोर जल को इसमें से प्रवाहित करते हैं तो जल में उपस्थित कैल्सियम तथा मैग्नीशियम के लवण इसके साथ क्रिया करते हैं। सोडियम परमाणुओं के स्थान पर कैल्सियम या मैग्नीशियम परमाणु आ जाते हैं तथा कैल्सियम या गैग्नीशियम परम्यूटिट बन जाता है।

वह जल जो परम्यूटिट परत से ऊपर उठता है, वह Ca2+ व Mg2+ आयनों से मुक्त होता है; अतः वह मृदु जल होता है जिसे पाइप द्वारा बाहर निकाला जा सकता है।
परम्यूटिट का पुनःनिर्माण (Regeneration of permutit)-कुछ समय बाद सम्पूर्ण Na2Z, CaZ व MgZ में परिवर्तित हो जाता है, परन्तु परम्यूटिट लम्बे समय तक कार्य नहीं करता। Na2Z के पुनर्निर्माण के लिए कठोर जल के प्रवेश को रोककर इसके स्थान पर 10% NaCl विलयन मिला दिया जाता है, तब Ca2+ वे Mg2+ आयन Na+ आयनों द्वारा प्रतिस्थापित हो जाते हैं जिससे परम्यूटिट को पुनःनिर्माण हो जाता है।

Ca2+ व Mg2+ आयन जल द्वारा धो दिए जाते हैं तथा पुनर्निर्मित परम्यूटिट का उपयोग पुनः कठोर जल को मृदु करने में किया जा सकता है।।
2. कार्बनिक आयन विनिमयक : संश्लेषित रेजिन विधि (Organic lon-Exchanger : Synthetic Resin Method)
आजकल इस आधुनिक विधि का प्रयोग काफी हो रहा है। परम्यूटिट केवल उन लवण के धनायनों (Ca2+ व Mg2+ ) को हटाता है जो जल को कठोर बनाते हैं। कार्बनिक रसायनज्ञों ने कुछ विशेष पदार्थ विकसित किए हैं, इन्हें आयन विनिमयक रेजिन (ion-exchanger resins) कहते हैं। ये लवण में उपस्थित ऋणायनों को भी हटा सकते हैं जो धनायनों की भाँति ही जल की कठोरता के लिए उत्तरदायी होते हैं। इस विधि से जल के मृदुकरण में निम्नलिखित दो प्रकार की रेजिन प्रयोग की जाती है-
(i) ऋणायन-विनिमयक रेजिन (Anion-exchanger resins)–वे रेजिन ऋणायन विनिमयक रेजिन कहलाते हैं जिनमें हाइड्रोकार्बन समूह के साथ क्षारीय समूह —OH अथवा —NH2 जुड़े रहते हैं जिन्हें —OH रेजिन के रूप में प्रदर्शित किया जाता है।
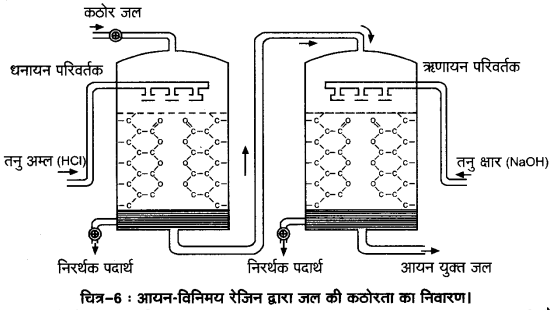
(ii) धनायन-विनिमयक रेजिन (Cation-exchanger resins)-ये हाइड्रोजन समूह ही हैं जिनके साथ अम्लीय समूह; जैसे-
—COOH या —SO3H समूह जुड़े रहते हैं तथा इन्हें धनायन विनिमयक रेजिन (H+ रेजिन) कहते हैं।
धनायन रेजिन, जल की कठोरता के उत्तरदायी धनायनों का विनिमय करते हैं, जबकि ऋणायन रेजिन, कठोरता के लिए उत्तरदायी ऋणायनों को हटाते हैं।
इसमें एक टंकी को एक रेजिन R– से लगभग आधा भरकर उसमें ऊपर से जल प्रवाहित करते हैं। रेजिन धनायनों को अवशोषित कर लेता है तथा टंकी से बाहर निकलने वाले जल में कैल्सियम और मैग्नीशियम धनायन नहीं होते; अत: जल मृदु हो जाता है। यह जल अलवणीकृत जल या अनआयनीकृत जल (demineralised water or deionised water) कहलाता है।
इसके पश्चात् इस मृदु जल को दूसरे ऐसे रेजिन R* में प्रवाहित करते हैं जो ऋणायनों को अवशोषित कर लेता है। कार्यविधि (Working procedure)-रेजिन R+ में विशाल कार्बनिक अणु होते हैं तथा उनमें अम्लीय क्रियात्मक समूह (—COOH, कार्बोक्सिलिक समूह) सम्मिलित रहते हैं। कठोर जल में उपस्थित धनायन Ca2+, Mg2+ इन अम्लीय क्रियात्मक समूहों द्वारा अवशोषित कर लिए जाते हैं तथा अम्ल से जल में H+ आयन आ जाते हैं।

अब पात्र में से जो जल निकलता है, वह धनायनों से मुक्त होता है, परन्तु इसमें ऋणात्मक आयन होते हैं। रेजिन R+ में विशाल कार्बनिक अणुओं के बीच विस्थापित अमोनियम हाइड्रॉक्साइड के दाने होते हैं जिनसे क्रियात्मक हाइड्रॉक्सिल समूह (OH–) संलग्न रहते हैं। कठोर जल में उपस्थित लवणों के ऋण विद्युती आयन, रेजिन R+ के अमोनियम आयनों (NH+4) से संयुक्त हो जाते हैं।
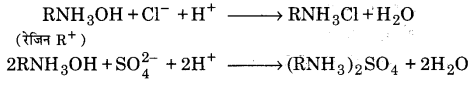
H+ आयन; जो धनायन रेजिन टैंक से आते हैं, इन OH– आयनों के साथ जुड़कर जल-अणु बना लेते हैं। अतः इस प्रकार प्राप्त जल उन सभी आयनों से मुक्त होता है जो कि जल को कठोर बनाते हैं। रेजिन का पुनःनिर्माण (Regeneration of resins)-कुछ समय बाद दोनों टैंकों में उपस्थित रेजिन पूर्णतया समाप्त हो जाते हैं; क्योंकि H+व OH– पूरी तरह प्रतिस्थापित हो जाते हैं। वे लम्बे समय तक जल की कठोरता को दूर नहीं कर सकते। इन्हें पुनः प्राप्त करने के लिए कठोर जल का प्रवेश रोक देते हैं। प्रथम टैंक में तनु HCl की धारा प्रवाहित करते हैं। अम्ल के H+ आयन्स समाप्त हो चुके रेजिन (exhausted resin) में Ca2+ व Mg2+ को प्रतिस्थापित कर H+, रेजिन का निर्माण करते हैं।

इसी प्रकार दूसरे टैंक में समाप्त हो चुके रेजिन को तनु सोडियम हाइड्रॉक्साइड विलयन में प्रवेश करा कर पुनर्निर्मित किया जा सकता है।

जब दोनों टैंकों में रेजिन पुनर्निर्मित हो जाता है तो अम्ल व क्षारक का प्रवेश रोक दिया जाता है। इनके स्थान पर पुन: धनायन रेजिन टैंक में कठोर जल को प्रवेश कराया जाता है। इस प्रकार एकान्तर क्रम में क्रियाएँ चलती रहती हैं तथा मृदु जल प्राप्त होता रहता है।
प्रश्न 24.
जल के उभयधर्मी स्वभाव को दर्शाने वाले रासायनिक समीकरण लिखिए।
उत्तर
जल की उभयधर्मी प्रकृति (Amphoteric nature of water)-जल अम्ल तथा क्षारक दोनों रूपों में व्यवहार करता है। अतः यह उभयधर्मी है। ब्रान्स्टेड अवधारणा के सन्दर्भ में जल NH, के साथ अम्ल के रूप में तथा H2S के साथ क्षारक के रूप में कार्य करता है-
H2O(l) +NH3(aq) → OH– (aq) + NH+4 (aq) …..(i)
H2O(l) + H2S(aq) →H2O+ (aq) +HS– (aq) ……(ii)
जल अपने से प्रबल अम्लों के साथ क्षारक की भाँति व्यवहार करता है; जैसे—उपर्युक्त अभिक्रिया (ii) में दर्शाया गया है। इसमें जल-अणु H2S से एक प्रोटॉन ग्रहण करके H3O+आयन बनाता है। अभिक्रिया (i) में जल-अणु एक प्रोटॉन का त्याग करता है। NH3 अणु इस प्रोटॉन को ग्रहण करके NH+4 आयन बनाता है।
प्रश्न 25.
हाइड्रोजन परॉक्साइड के ऑक्सीकारक एवं अपचायक रूप को अभिक्रियाओं द्वारा समझाइए।
उत्तर
हाइड्रोजन परॉक्साइड के अपघटन के दौरान ऑक्सीकरण-अवस्था परिवर्तन निम्नवत् दर्शाया। जा सकता है-

चूँकि H2O2 में उपस्थित ऑक्सीजन परमाणुओं की ऑक्सीकरण संख्या में वृद्धि तथा कमी दोनों होती हैं; इसलिए यह अपचायक तथा ऑक्सीकारक दोनों की भाँति कार्य कर सकता है। इसे निम्नलिखित अभिक्रियाओं द्वारा समझा जा सकता है-

प्रश्न 26.
विखनिजित जल से क्या अभिप्राय है? यह कैसे प्राप्त किया जा सकता है?
उत्तर
वह जल जो सभी विलेयशील खनिज अशुद्धियों से पूर्णतया मुक्त हो, विखनिजित जल (demineralised water) कहलाता है। दूसरे शब्दों में, धनायनों (Ca2+, Mg2+ आदि) तथा ऋणायनों (Cl–, SO2-4, HCO–3 आदि) से पूर्णतया विमुक्त जल विखनिजित जल कहलाता है। विखनिजित जल को आयन-विनिमयक रेजिन विधि से प्राप्त किया जाता है। इस विधि के अन्तर्गत आयन-विनिमयक रेजिनों द्वारा जल में उपस्थित सभी धनायनों तथा ऋणायनों को हटा दिया जाता है। इसके लिए सर्वप्रथम कठोर जल को धनायन विनिमय परिवर्तक (रेजिनयुक्त) में प्रवाहित किया जाता है, जहाँ —SO3H तथा —COOH समूहों वाले विशाल कार्बनिक अणु (रेजिन), Na+, Ca2+, Mg2+ तथा अन्य धनायनों को हटाकर H+ आयनों को प्रतिस्थापित कर देते हैं। इस प्रकार प्राप्त जल को पुन: ऋणायन विनिमय परिवर्तक से गुजारा जाता है, जहाँ —NH2 समूह वाले विशाल कार्बनिक अणु (रेजिन) Cl–, SO2-4, HCO–3 आदि ऋणायनों को हटाकर OH– आयनों को प्रतिस्थापित कर देते हैं।
जल के उत्तरोत्तर धनायन-विनिमयक (H+ आयन के रूप में) तथा ऋणायन-विनिमयक (OH–) के रूप में) रेजिन से प्रवाहित करने पर शुद्ध विखनिजित तथा विआयनित जल प्राप्त किया जाता है।
प्रश्न 27.
क्या विखनिजित या आसुत जल पेय-प्रयोजनों में उपयोगी है? यदि नहीं तो इसे उपयोगी कैसे बनाया जा सकता है?
उत्तर
विखनिजित या आसुत जल पीने के लिए उपयोगी नहीं है क्योंकि यह स्वादहीन होता है तथा इसमें मानव स्वास्थ्य लिए आवश्यक खनिज पदार्थ विद्यमान नहीं होते। इसमें निश्चित मात्रा में आवश्यक खनिज पदार्थ मिलाकर इसे पीने योग्य बनाया जा सकता है।
प्रश्न 28.
जीवमण्डल एवं जैव-प्रणालियों में जल की उपादेयता को समझाइए।
उत्तर
जल एक अत्यन्त आवश्यक शारीरिक द्रव (vital body fluid) है और जीवन के सभी रूपों के लिए आवश्यक है। हाइड्रोजन आबन्ध (hydrogen bonding) के कारण इसके क्वथनांक (boiling point), हिमांक (freezing point), संलयन ऊष्मा (heat of fusion) और वाष्पन की ऊष्मा (heat of vaporisation) सामान्य मानों से काफी अधिक होते हैं।
जल के असामान्य भौतिक गुण जैव मण्डल में महत्त्वपूर्ण भूमिका निभाते हैं। जल के वाष्पीकरण की उच्च ऊष्मा तथा इसकी ऊष्मा ग्रहण करने की उच्च क्षमता वातावरण पर जल के मृदुल प्रभाव और जीवित प्राणियों के शरीर के ताप नियन्त्रण के लिए उत्तरदायी है।
जल का क्वाथनांक उच्च होने के कारण यह सामान्य ताप पर द्रव अवस्था में रहता है, अन्यथा पृथ्वी पर जल द्रव अवस्था में शेष ही नहीं रहता। जल एक बहुत अच्छा (excellent) विलायक है। कुछ सहसंयोजक कार्बनिक यौगिक जैसे ऐल्कोहॉल और कार्बोहाइड्रेट, जल (H2O) अणुओं के साथ हाइड्रोजन आबन्ध बनाते हैं जिस कारण ये जल में घुल जाते हैं। अपनी उत्तम विलायक क्षमता के कारण जल पौधों और प्राणियों में होने वाले उपापचयी क्रियाओं के लिए आवश्यक आयनों व अणुओं के परिवहन में सहायता करता है। अतः जल जैव मण्डल और जैविक तन्त्र के लिए अति आवश्यक है।
प्रश्न 29.
जल का कौन-सा गुण इसे विलायक के रूप में उपयोगी बनाता है? यह किस प्रकार के यौगिक-
(i) घोल सकता है और
(ii) जल-अपघटन कर सकता है?
उत्तर
जल का डाइइलेक्ट्रिक स्थिरांक (78.39) तथा द्विध्रुव आघूर्ण (1.84D) उच्च होते हैं। इन गुणों के कारण, जल एक उत्तम विलायक (excellent solvent) है जो अकार्बनिक और अनेक सहसंयोजक यौगिकों (जैसे-ऐल्कोहॉल, अम्ल, कार्बोहाइड्रेट आदि) को घोल सकता है। यही कारण है कि जल एक सार्वत्रिक विलायक (universal solvent) कहा जाता है। यह आयनिक यौगिकों को आयन-द्विध्रुव अन्तराकर्षण (ion-dipole interaction) और सहसंयोजक यौगिकों को हाइड्रोजन आबन्ध के कारण घोल देता है। जल बहुत से ऑक्साइड, हाइड्राइड, कार्बाइड, नाइट्राइड, फॉस्फाइड आदि को जल अपघटित (hydrolyse) कर सकता है।
प्रश्न 30.
H2O एवं D2O के गुणों को जानते हुए क्या आप मानते हैं कि D2O का उपयोग पेय-प्रयोजनों के रूप में किया जा सकता है?
उत्तर
D2O पेय-प्रयोजनों हेतु उपयोग नहीं किया जा सकता, क्योंकि यह जहरीला होता है। यह पौधों की वृद्धि (growth) को मन्द कर देता है। यद्यपि यह एक कीटाणुनाशक व जीवाणुनाशक है, फिर भी यह पेय-प्रयोजनों के रूप में उपयोग नहीं होता क्योंकि सामान्य जल में भारी जल की अधिक मात्रा उसे विषैली बनाती है।
प्रश्न 31.
‘जल-अपघटन’ (hydrolysis) तथा ‘जलयोजन’ (hydration) पदों में क्या अन्तर है?
उत्तर
जल-अपघटन से जल के H+ तथा OH– आयन लवण के क्रमश: ऋणायन तथा धनायन से क्रिया कर मूल अम्ल तथा मूल क्षार (original base) का निर्माण करते हैं। जैसे,

जलयोजन (hydration) में जल (H2O), लवण के अणु अथवा आयनों के साथ जुड़कर जलयोजित लवण (hydrated salt) या जलयोजित आयन (hydrated ion) बनाता है। जैसे,

प्रश्न 32.
लवणीय हाइड्राइड किस प्रकार कार्बनिक यौगिकों से अति सूक्ष्म जल की मात्रा को हटा सकते हैं?
उत्तर
लवणीय हाइड्राइड (जैसे–NaH, CaH2) कमरे के ताप पर जल से अभिक्रिया करके उनके हाइड्रॉक्साइड बनाते हैं तथा H2 गैस निकालते हैं। इस गुण के कारण इनका उपयोग कार्बनिक यौगिकों से जल की अति सूक्ष्म मात्रा निकालने में किया जाता है। जिस कार्बनिक यौगिक को शुद्ध करना होता है। उसे एक लवणीय हाइड्राइड के साथ आसवित किया जाता है। H2 वायुमण्डल में निष्कासित हो जाती। है और धात्विक हाइड्रॉक्साइड फ्लास्क में शेष रह जाता है। जल रहित कार्बनिक यौगिक आसवित हो। जाता है।
प्रश्न 33.
परमाणु क्रमांक 15, 19, 23 तथा 44 वाले तत्व यदि डाइहाइड्रोजन से अभिक्रिया कर हाइड्राइड बनाते हैं तो उनकी प्रकृति से आप क्या आशा करेंगे? जल के प्रति इनके व्यवहार की तुलना कीजिए।
उत्तर
- तत्त्व जिसका Z = 15 है, फॉस्फोरस (एक धातु) है। यह एक सहसंयोजक हाइड्राइड PH; बनता है।
- तत्त्व जिसका Z= 19 है पोटैशियम (एक क्षार धातु) है। यह एक लवणीय हाइड्राइड (saline | hydride) K+H– बनाता है।
- तत्त्व जिसका Z = 23 है, वेनेडियम (एक संक्रमण धातु) है। यह एक धात्विक हाइड्राइड VH0.56 बनाता है।
- तत्त्व जिसका Z= 44 है, रथनियम (एक समूह-8-तत्त्व) है। यह कोई हाइड्राइड नहीं बनाता है। उपर्युक्त सभी हाइड्राइडों में से पोटैशियम हाइड्राइड जल से अभिक्रिया करता है जैसा नीचे दिखाया गया है।
2KH(s) + 2H2O(l) → 2KOH(aq) + 2H2 (g)
प्रश्न 34.
जब ऐलुमिनियम (III) क्लोराइड एवं पोटैशियम क्लोराइड को अलग-अलग-
(i) सामान्य जल,
(ii) अम्लीय जल एवं
(iii) क्षारीय जल से अभिकृत कराया जाएगा तो |आप किन-किन विभिन्न उत्पादों की आशा करेंगे? जहाँ आवश्यक हो, वहाँ रासायनिक समीकरण दीजिए।
उत्तर
पोटैशियम क्लोराइड (KCI) प्रबल क्षार और अम्ल से बना लवण है। साधारण जल में यह अपने संघटक आयनों में विघटित हो जाता है। इस प्रक्रम में कोई जल-अपघटन नहीं होता है।
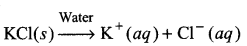
KCI का जलीय विलयन उदासीन होता है। इसलिए यह अम्लीय जल में अथवा क्षारीय जल में कोई अभिक्रिया प्रदर्शित नहीं करता है।
ऐलुमिनियम क्लोराइड (AlCl3) दुर्बल क्षार और प्रबल अम्ल से बना लवण है। यह सामान्य जल में जल-अपघटित (hydrolyse) होकर अम्लीय विलयन बनाता है, जैसा नीचे दिखाया गया है।
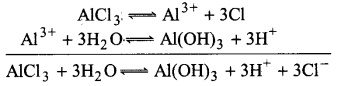
अम्लीय जल में H+ आयन Al(OH)3 से क्रिया करके Al3+ आयन और H2O बनाता है। इस प्रकार अम्लीय जल में जल-अपघटन प्रक्रिया अवरुद्ध हो जाती है और Al3+ और Cl– आयन विलयन में स्थित रहते हैं।

क्षारीय जल में Al(OH)3 क्रिया करके AlO–2 आयन देता है।
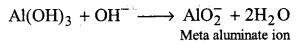
प्रश्न 35.
H2O2 विरंजन कारक के रूप में कैसे व्यवहार करता है? लिखिए।
उत्तर
H2O के विरंजक गुण का कारण इसके अपघटन से उत्पन्न होने वाली नवजात ऑक्सीजन
H2O2 → H2O+[O]
नवजात ऑक्सीजन (nascent oxygen) रंगीन पदार्थों को रंगहीन उत्पादों में ऑक्सीकृत कर देती है।
रंगीन पदार्थ +[O] → रंगहीन
इस प्रकार, H2O2 का विरंजक गुण रंगीन पदार्थों के नवजात ऑक्सीजन द्वारा ऑक्सीकरण के कारण है। इसका उपयोग रेशम, वॉल, लकड़ी, सूती वस्त्र आदि के विरंजक के रूप में किया जाता है।
प्रश्न 36.
निम्नलिखित पदों से आप क्या समझते हैं?
(i) हाइड्रोजन अर्थव्यवस्था,
(ii) हाइड्रोजनीकरण,
(iii) सिन्गैस,
(iv) भाप अंगार गैस सृति अभिक्रिया तथा
(v) ईंधन सेल।
उत्तर
(i) हाइड्रोजन अर्थव्यवस्था (Hydrogen Economy)
हम सभी जानते हैं कि कोयला तथा पेट्रोलियम सर्वाधिक प्रयुक्त होने वाले ईंधन हैं, परन्तु ये संसाधन अत्यन्त तीव्र दर से समाप्त होते जा रहे हैं तथा आगामी भविष्य में उद्योग तथा परिवहन इससे बहुत अधिक प्रभावित हो सकते हैं। इसके अतिरिक्त ये संसाधन मानव-स्वास्थ्य के प्रति भी अत्यन्त हानिकारक हैं; क्योंकि ये वायु प्रदूषण के प्रमुख कारक हैं। इनके दहन के फलस्वरूप उत्पन्न अनेक विषाक्त गैसे-कार्बन मोनोक्साइड, नाइट्रोजन तथा सल्फर के ऑक्साइड वायुमण्डल में मिल जाती हैं। इन समस्याओं से निपटने के लिए वैकल्पिक ईंधनों की खोज सदैव होती रही है। इस सन्दर्भ में भावी विकल्प ‘हाइड्रोजन अर्थव्यवस्था है। हाइड्रोजन अर्थव्यवस्था का मूल सिद्धान्त ऊर्जा का द्रव हाइड्रोजन अथवा गैसीय हाइड्रोजन के रूप में अभिगमन तथा भण्डारण है। हाइड्रोजन अर्थव्यवस्था का मुख्य ध्येय तथा लाभ–ऊर्जा का संचरण विद्युत-ऊर्जा के रूप में न होकर हाइड्रोजन के रूप में होना है। हमारे देश में पहली बार अक्टूबर, 2005 में आरम्भ परियोजना में डाइहाइड्रोजन स्वचालित वाहनों के ईंधन के रूप में प्रयुक्त किया गया। प्रारम्भ में चौपहिया वाहन के लिए 5 प्रतिशत डाइहाइड्रोजन मिश्रित CNG को प्रयोग किया गया। बाद में डाइहाइड्रोजन की प्रतिशतता धीरे-धीरे अनुकूलतम स्तर तक बढ़ाई जाएगी।
आजकल डाइहाइड्रोजन का उपयोग ईंधन सेलों में विद्युत उत्पादन के लिए किया जाता है। ऐसी आशा की जाती है कि आर्थिक रूप से व्यवहार्य तथा डाइहाइड्रोजन के सुरक्षित स्रोत का पता आने वाले वर्षों में लग सकेगा तथा उसका उपयोग ऊर्जा के रूप में हो सकेगा।
(ii) हाइड्रोजनीकरण (Hydrogenation)
असंतृप्त कार्बनिक यौगिक हाइड्रोजन से सीधे संयोग करके संतृप्त यौगिक बनाते हैं, यह अभिक्रिया
हाइड्रोजनीकरण कहलाती है। यह अभिक्रिया उत्प्रेरक की उपस्थिति में होती है तथा इन अभिक्रियाओं से अनेक महत्त्वपूर्ण औद्योगिक हाइड्रोजनीकृत उत्पाद प्राप्त होते हैं।
वनस्पति तेलों का हाइड्रोजनीकरण (Hydrogenation of Vegetable Oils)-473K पर निकिल उत्प्रेरक की उपस्थिति में वनस्पति तेलों; जैसे-मूंगफली के तेल, बिनौले के तेल में हाइड्रोजन गैस प्रवाहित करने पर तेल ठोस वसाओं, जिन्हें वनस्पति घी कहा जाता है, में परिवर्तित हो जाते हैं। वास्तव में तेल  बन्ध की उपस्थिति के कारण असंतृप्त होते हैं। हाइड्रोजनीकरण पर ये बन्ध
बन्ध की उपस्थिति के कारण असंतृप्त होते हैं। हाइड्रोजनीकरण पर ये बन्ध  बन्ध में परिवर्तित हो जाते हैं जिसके परिणामस्वरूप असंतृप्त तेल संतृप्त वसा में परिवर्तित हो जाते हैं।
बन्ध में परिवर्तित हो जाते हैं जिसके परिणामस्वरूप असंतृप्त तेल संतृप्त वसा में परिवर्तित हो जाते हैं।

ओलिफिन का हाइड्रोफॉर्मिलीकरण (Hydroformylation of Olefins)-ओलिफिन का हाइड्रोफॉर्मिलीकरण कराने पर ऐल्डिहाइड प्राप्त होता है, जो ऐल्कोहॉल में अपचयित हो जाता है।
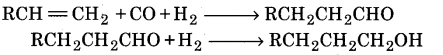
उपर्युक्त के अतिरिक्त कोयले का हाइड्रोजनीकरण करने पर द्रव हाइड्रोकार्बनों का मिश्रण प्राप्त होता है। जिसे आसुत करने पर कृत्रिम पेट्रोल प्राप्त होता है।
(iii) सिनौस (Syngas) हाइड्रोकार्बन अथवा कोक की उच्च ताप पर एवं उत्प्रेरक की उपस्थिति में भाप से अभिक्रिया कराने पर डाइहाइड्रोजन प्राप्त होती है।

उदाहरणस्वरूप-

CO एवं H2 के मिश्रण को वाटर गैस कहते हैं। CO एवं H2 का यह मिश्रण मेथेनॉल तथा अन्य कई हाइड्रोकार्बनों के संश्लेषण में काम आता है। अतः इसे ‘संश्लेषण गैस’ या ‘सिन्गैस’ (syngas) भी कहते हैं। आजकल सिन्गैस वाहितमले (sewage waste), अखबार, लकड़ी का बुरादा, लकड़ी की छीलन आदि से प्राप्त की जाती है। कोल से सिन्गैस का उत्पादन करने की प्रक्रिया को ‘कोलगैसीकरण (coal-gasification) कहते हैं-

(iv) भाप-अंगार गैस सृति अभिक्रिया (Water gas Shift reaction) सिन्गैस में उपस्थित कार्बन मोनोक्साइड की आयरन क्रोमेट उत्प्रेरक की उपस्थिति में भाप से क्रिया कराने पर डाइहाइड्रोजन का उत्पादन बढ़ाया जा सकता है-

यह ‘भाप-अंगार गैस सृति अभिक्रिया’ (water gas shift reaction) कहलाती है। वर्तमान में लगभग 77 प्रतिशत डाइहाइड्रोजन का औद्योगिक उत्पादन शैल रसायनों (petro-chemicals), 18 प्रतिशत कोल, 4 प्रतिशत जलीय विलयनों के विद्युत-अपघटन तथा 1 प्रतिशत उत्पादन अन्य स्रोतों से होता है।
(v) ईंधन सेल (Fuel Cell) , वह युक्ति जो ईंधन की रासायनिक ऊर्जा को विद्युत ऊर्जा में परिवर्तित करती है, ईंधन सेल कहलाती है। आजकल डाइहाइड्रोजन का प्रयोग ईंधन सेलों में विद्युत-उत्पादन के लिए किया जाता है।
परीक्षोपयोगी प्रश्नोत्तर
बहुविकल्पीय प्रश्न
प्रश्न 1.
ड्यूटीरियम के खोजकर्ता हैं।
(i) लूईस
(ii) मेन्जेल
(iii) टेलर
(iv) यूरे
उत्तर
(iv) यूरे
प्रश्न 2.
ट्राइटियम में होता है
(i) एक प्रोटॉन तथा दो न्यूट्रॉन
(ii) एक न्यूट्रॉन तथा दो प्रोटॉन
(iii) एक इलेक्ट्रॉन तथा दो प्रोटॉन
(iv) एक इलेक्ट्रॉन, एक प्रोटॉन तथा एक न्यूट्रॉन
उत्तर
(i) एक प्रोटॉन तथा दो न्यूट्रॉन
प्रश्न 3.
हाइड्रोजन का रेडियोऐक्टिव समस्थानिक है
(i) 1H1
(ii) 1H2
(iii) 1H3
(iv) इनमें से कोई नहीं …..
उत्तर
(iii) 1H3
प्रश्न 4.
सबसे अधिक क्रियाशील है।
(i) साधारण हाइड्रोजन
(ii) पैरा हाइड्रोजन
(iii) ऑर्थो हाइड्रोजन
(iv) नवजात हाइड्रोजन
उत्तर
(iv) नवजात हाइड्रोजन
प्रश्न 5.
निम्न में से हाइड्राइड हाइड्रोलिथ कहलाता है।
(i) NaH
(ii) CaH2
(iii) AlH2
(iv) BeH2
उत्तर
(ii) CaH2
प्रश्न 6.
जल की कठोरता इनकी उपस्थिति के कारण होती है।
(i) CaCO3 वे MgCO3
(ii) NaCl व Na2SO4
(iii) Na2CO3 व Na2SO4
(iv) CaCl2 वे CaSO4
उत्तर
(i) CaCO3 व MgCO3
प्रश्न 7.
कौन-सा ऑक्साइड तनु अम्ल के साथ क्रिया कराने पर H,0, देता है?
(i) MnO2
(ii) PbO2
(iii) BaO2
(iv) इनमें से कोई नहीं
उत्तर
(iii) BaO2
प्रश्न 8.
10 आयतन हाइड्रोजन परॉक्साइड विलयन की नॉर्मलता है लगभग
(i) 2 N
(ii) 18N
(iii) 2.5N
(iv) 1.5N
उत्तर
(ii) 18N
प्रश्न 9.
15 आयतन वाले H2O2 की प्रतिशत सान्द्रता होगी
(i) 6.08%
(ii) 92%
(iii) 4.56%
(iv) 5.6%
उत्तर
(iii) 4.56%
प्रश्न 10.
H2O2 के 6% (w/v) विलयन की आयतन सान्द्रता क्या होगी?
(i) 18 आयतन
(ii) 20 आयतन
(iii) 24 आयतन
(iv) 30 आयतन
उत्तर
(ii) 20 आयतन
प्रश्न 11.
H2O2 के 1.5 N विलयन की आयतन सान्द्रता है।
(i) 3.0
(ii) 4.8
(iii) 8.4
(iv) 80
उत्तर
(iii) 8.4
प्रश्न 12.
H2O2 को अपघटन से बचाने के लिए मिलाया जाता है।
(i) यूरिया
(ii) थायोयूरिया
(iii) नेफ्थैलीन
(iv) इनमें से कोई नहीं
उत्तर
(i) यूरिया
प्रश्न 13.
H2O2 प्रयुक्त होता है।
(i) केवल ऑक्सीकारक के रूप में
(ii) केवल अपचायक के रूप में।
(iii) केवल अम्ल के रूप में ,
(iv) ऑक्सीकारक, अपचायक तथा अम्ल के रूप में
उत्तर
(iv) ऑक्सीकारक, अपचायक तथा अम्ल के रूप में
प्रश्न 14.
भारी जल की खोज के द्वारा हुई?
(i) लूईस और मैक्डोनाल्ड द्वारा
(ii) यूरे और वाशबर्न द्वारा
(iii) टेलर, आइरिंग तथा फ्रॉस्ट द्वारा
(iv) बर्ग और मेन्जेल द्वारा
उत्तर
(ii) यूरे और वाशबर्न द्वारा
प्रश्न 15.
भारी जल का अणु भार होता है।
(i) 10
(ii) 18
(iii) 20
(iv) 22
उत्तर
(iii) 20
प्रश्न 16.
जल के उच्चतम घनत्व का ताप 4°C है। भारी जल के उच्चतम घनत्व का ताप होगा
(i) 61°C
(ii) 81°C
(iii) 93°C
(iv) 112°C
उत्तर
(iv) 112°C
प्रश्न 17.
भारी जल न्यूक्लियर रिएक्टरों में प्रयुक्त किया जाता है।
(i) शीतलक के रूप में
(ii) ईंधन के रूप में।
(iii) मन्दक के रूप में
(iv) इनमें से कोई नहीं
उत्तर
(iii) मन्दक के रूप में
अतिलघु उत्तरीय प्रश्न
प्रश्न 1.
हाइड्रोजन के उस समस्थानिक का नाम लिखिए जिसमें समान संख्या में न्यूट्रॉन तथा प्रोटॉन हैं।
उत्तर
ड्यूटीरियम में समान संख्या में अर्थात् एक प्रोटॉन व एक न्यूट्रॉन होता है।
प्रश्न 2.
ड्यूटीरियम के दो मुख्य उपयोग लिखिए।
उत्तर
ड्यूटीरियम के दो मुख्य उपयोग निम्नवत् हैं।
- इसका उपयोग D2O, ND3,CD2 आदि यौगिक बनाने में किया जाता है।
- इसके नाभिक का उपयोग कृत्रिम विघटन प्रक्रियाएँ कराने में एक प्रक्षेप्य के रूप में किया जाता
प्रश्न 3.
रॉकेटों में द्रव हाइड्रोजन को आदर्श ईंधन के रूप में क्यों माना जाता है।
उत्तर
द्रव हाइड्रोजन में निम्नलिखित विशेषताएँ होने के कारण इसे रॉकेटों में आदर्श ईंधन के रूप में प्रयुक्त किया जाता है।
- इससे प्रदूषण उत्पन्न नहीं होता है।
- इससे ऊर्जा लगातार लम्बे समय तक प्राप्त की जाती है।
- इसका कैलोरी मान अधिक (दक्षता) होता है।
प्रश्न 4.
आयनिक हाइड्राइड, सहसंयोजी हाइड्राइड तथा अन्तराकाशी हाइड्राइड का एक-एक उदाहरण दीजिए।
उत्तर
आयनिक हाइड्राइड – LiH व NaH
सहसंयोजी हाइड्राइड – BH3 व AlH3
अन्तराकाशी हाइड्राइड – CrH
प्रश्न 5.
जिओलाइट तथा केलगॉन का रासायनिक सूत्र लिखिए।
उत्तर
जिओलाइट का रासायनिक सूत्र Na2Al2Si2O8.xH2O है।
केलगॉन का रासायनिक सूत्र Na2 [Na4 (Po3 )6] है।
प्रश्न 6.
भारी जल क्या है? इसका सूत्र लिखिए। इसका प्रमुख उपयोग भी लिखिए।
उत्तर
भारी हाइड्रोजन अर्थात् ड्यूटीरियम के ऑक्साइड (D2O) को भारी जल कहते हैं। इसका अणुभार 200276 g/mol है। इसका प्रयोग मुख्यत: न्यूक्लियर रिएक्टरों में नाभिकीय अभिक्रियाओं में उत्पन्न तीव्रगामी न्यूट्रॉनों की चाल को कम करने के लिए मंदक के रूप में किया जाता है।
प्रश्न 7.
भारी हाइड्रोजन बनाने की एक विधि लिखिए।
उत्तर
प्रयोगशाला में भारी हाइड्रोजन अथवा ड्यूटीरियम को भारी जल के विद्युत अपघटन द्वारा प्राप्त किया जाता है।
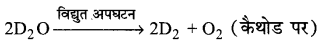
प्रश्न 8.
साधारण जल से भारी जल कैसे बनाते हैं?
उत्तर
साधारण जल से भारी जल का निर्माण निम्न में से किसी भी एक विधि का उपयोग करके किया जा सकता है।
- साधारण जल के प्रभाजी आसवन द्वारा,
- साधारण जल के विद्युत अपघटन द्वारा,
- रासायनिक विनिमय विधि द्वारा।
प्रश्न 9.
क्या होता है जब D2O को कैल्सियम कार्बाइड में मिलाते हैं?
उत्तर
जब D2O को कैल्सियम कार्बाइड में मिलाते हैं, तो कैल्सियम ड्यूटेरॉक्साइड व ड्यूटेरोऐसीटिलीन प्राप्त होता है। अभिक्रिया का समीकरण निम्नवत् है।

लघु उत्तरीय प्रश्न
प्रश्न 1.
ऑर्थों तथा पैरा-हाइड्रोजन को समझाइए।
उत्तर
प्रोटॉनों के चक्रण की दिशा के आधार पर हाइड्रोजन के निम्नलिखित दो अपररूप होते हैं।
- ऑर्थों हाइड्रोजन-जब प्रोटॉनों के चक्रण समान दिशा में होते हैं, तो उसे ऑर्थो हाइड्रोजन कहते हैं।
- पैरा हाइड्रोजन-जब प्रोटॉनों के चक्रण विपरीत दिशा में होते हैं, तो उसे पैरा हाइड्रोजन कहते
पैरा हाइड्रोजन, ऑर्थों हाइड्रोजन से अधिक स्थायी होती है क्योंकि पैरा हाइड्रोजन की आन्तरिक ऊर्जा ऑर्थो हाइड्रोजन से कम है।
प्रश्न 2.
आप प्रयोगशाला में डाइहाइड्रोजन गैस का विरचन कैसे करेंगे?
उत्तर
प्रयोगशाला में डाइहाइड्रोजन गैस दानेदारः जिंक पर तनु सल्फ्यूरिक अम्ल की अभिक्रिया से बनायी जाती है। अभिक्रिया का समीकरण निम्नवत् है-
Zn + H2SO4 (dil.) → 4 ZnSO4 + H2 ↑
एक वुल्फ बोतल में दानेदार जिंक के टुकड़े लेकर उन्हें जल से ढक देते हैं। कॉर्क की सहायता से वुल्फ बोतल के एक मुँह में थिसिल कीप तथा दूसरे में निकास नली लगाते हैं। निकास नली के दूसरे सिरे को सछिद्र आसन के नीचे रखते हैं जो कि जल से भरी द्रोणिका में रखा जाता है। थिसिल कीप की सहायता से बोतल में धीरे-धीरे सान्द्र सल्फ्यूरिक अम्ल डालते हैं। सान्द्र सल्फ्यूरिक अम्ल बोतल में तनु हो जाता है। तनु सल्फ्यूरिक अम्ल जिंक से अभिक्रिया करके H2 गैस उत्पन्न करता है। प्रारम्भ में जो गैस वुल्फ बोतल से निकलती है उसमें वायु भी मिली होती है। अतः इसे कुछ देर निकलने देते हैं। इसके पश्चात् जल में भरा उल्टा गैस जार सछिद्र आसन के ऊपर रख देते हैं। इस प्रकार डाइहाइड्रोजन गैस जल के अधोमुखी विस्थापन द्वारा गैस जार में एकत्रित हो जाती है।
प्रश्न 3.
हाइड्रोजन के गुणधर्म तथा उपयोग लिखिए।
उत्तर
हाइड्रोज़न के प्रमुख गुणधर्म निम्नवत् हैं-
- यह रंगहीन, गंधहीन, स्वादहीन एवं जल में अविलेय गैस है।
- गैसों में हाइड्रोजन सबसे हल्की गैस है। S.T.P पर हाइड्रोजन गैस का घनत्व 0.09 ग्राम/लीटर होता है।
- हाइड्रोजन का गलनांक -2592°C और क्वथनांक -2528°C होता है।
- हाइड्रोजन गैस ज्वलनशील है परन्तु यह जलने में सहायता नहीं करती है।
हाइड्रोजन के प्रमुख उपयोग निम्नवत् हैं
- हाइड्रोजन का उपयोग अपचायक के रूप में होता है।
- ऑक्सी-हाइड्रोजन ज्वाला प्राप्त करने में इसका उपयोग होता है। इस ज्वाला का ताप बहुत उच्च होता है। जिसका प्रयोग धातुओं को काटने, पिघालने और जोड़ने (welding) में होता है।
- वनस्पति तेलों के हाइड्रोजनीकरण द्वारा वनस्पति घी के उत्पादन में।
- अमोनियम के निर्माण में।
- कृत्रिम पेट्रोल के निर्माण में।
- ईंधन के रूप में।
प्रश्न 4.
कठोर तथा मृदु जल में विभेद कीजिए।
उत्तर
कठोर तथा मृदु जल में विभेद-वह जल जो साबुन के साथ आसानी से झाग नहीं देता है, कठोर जल कहलाता है। समुद्रों, झीलों, नदियों, कुओं, टोंटी आदि का जल कठोर जल होता है जबकि वह जल जो साबुन के साथ आसानी से झाग देता है, मृदु जल कहलाता है। आसुत जल मृदु जल का उदाहरण है।
प्रश्न 5.
कठोर जल साबुन के साथ आसानी से झाग क्यों नहीं देता है?
उत्तर
कठोर जल में कैल्सियम तथा मैग्नीशियम के बाइकार्बोनेट, क्लोराइड तथा सल्फेट लवण घुले रहते हैं। जल में उपस्थित ये लवण साबुन के साथ अभिक्रिया करके मलफेन अथवा अबक्षेप बना लेते हैं इसलिए यह जल साबुन के साथ आसानी से झाग नहीं देता है।

प्रश्न 6.
परॉक्साइड तथा डाइऑक्साइड के अन्तर को उदाहरण देकर समझाइए।
उत्तर

प्रश्न 7.
30 आयतन हाइड्रोजन परॉक्साइड की सान्द्रता ग्राम प्रति लीटर में ज्ञात कीजिए।
उत्तर
∵ 1 मिली H2O2 विलयन से N.T:P. पर उत्पन्न O2 = 30 मिली
∴ 1000 मिली H2O2 विलयन से N.T.P पर उत्पन्न O2 = 1080×30:मिली = 30 लीटर H2O2 के विघटन समीकरण से,

प्रश्न 8.
18 आयतन हाइड्रोजन परॉक्साइड की नॉर्मलता की गणना कीजिए।
उत्तर

प्रश्न 9.
क्या होता है जब
1. क्रोमियम सल्फेट की सोडियम हाइड्रॉक्साइड की उपस्थिति में HJ0, से क्रिया कराते
2. H2O2 को अम्लीकृत पोटैशियम परमैंगनेट विलयन में मिलाते हैं?
3. H2O2 को सिल्वर ऑक्साइड में मिलाते हैं?
4. H2O2 को लेड सल्फाइड में मिलाते हैं?
उत्तर

प्रश्न 10.
एक अज्ञात यौगिक (X) का जलीय विलयन निम्न अभिक्रियाएँ देता हैं।
(i) क्षारीय KMnO, के साथ भूरा अवक्षेप देता है।
(ii) KI के जलीय विलयन के साथ I2 निकालता है। यौगिक X की पहचान कीजिए तथा (i) व (ii) से सम्बन्धित अभिक्रियाओं के केवल
समीकरण दीजिए।
उत्तर
उपर्युक्त प्रयोगों के आधार पर अज्ञात यौगिक (X) के H2O2 होने की सम्भावना लगती है। अभिक्रियाओं के समीकरण निम्नवत् है ।
- 2KMnO4 + 3H2O2 → 2MnO2 + 2KOH + 2H2O+ 3O2
- H2O2 + 2KI→ 2KOH + I2
उपर्युक्त समीकरणों के आधार पर अज्ञात यौगिक (X) की H2O2 होने की पुष्टि होती है।
प्रश्न 11.
भारी जल क्या है? इससे ड्यूटीरियम कैसे प्राप्त करेंगे? इसके दो मुख्य उपयोग लिखिए। इसकंन एक जैविक प्रभाव भी लिखिए।
उत्तर
ड्यूटीरियम ऑक्साइड को भारी जल कहते हैं। यह धातुओं से क्रिया करके ड्यूटीरियम देता है।
2Na + 2D2O → 2NaOD + D2
इसके उपयोग निम्नवत् हैं-
- ड्यूटीरियम तथा इसके यौगिक बनाने में काम आता है।
- इसका उपयोग परमाणु भट्ठी में न्यूट्रॉनों की गति को मन्द करने के लिए होता है।
- इसका उपयोग आरेख (tracer) के रूप में रासायनिक तथा जैव अभिक्रियाओं की क्रिया-विधि के अध्ययन में होता है।
- आयनिक व अन-आयनिक हाइड्रोजन में विभेद करने में-आयनिक हाइड्रोजन तथा N2 या O2 से जुड़ी हुई हाइड्रोजन का ड्यूटीरियम द्वारा विनिमय होता है, अतः यौगिकों में हाइड्रोजन की प्रकृति के बारे में जानकारी प्राप्त की जा सकती है। जैविक प्रभाव–भारी जल पेड़-पौधों के विकास को रोक देता है।
प्रश्न 12.
भारी जल का निम्न पर क्या प्रभाव पड़ता है ? मनुष्य के शरीर पर, बीजों के अंकुरण पर।
उत्तर
भारी जल साधारण जल की अपेक्षा मंद गति से क्रिया करता है। इसलिए शरीर में होने वाली कई अभिक्रियाओं का वेग कम हो जाता है और सामान्य अभिक्रियाओं का सन्तुलन बिगड़ जाता है। भारी जल में बीजों का अंकुरण धीमा हो जाता है या रुक जाता है।
विस्तृत उत्तरीय प्रश्न
प्रश्न 1.
हाइड्राइड से आप क्या समझते हैं। विस्तृत वर्णन कीजिए।
उत्तर
हाइड्राइड-हाइड्रोजन निश्चित परिस्थितियों में उत्कृष्ट गैसों के अतिरिक्त लगभग सभी तत्वों के साथ संयोग करके द्विअंगी यौगिक (binary compounds) बनाती है जिन्हें हाइड्राइड कहते हैं। जैसे—NaH2 CaH2 AlH2 CH2, NH2, H2O, H2S आदि। IUPAC पद्धति के अनुसार, वे धातु अथवा अधातु जिनकी विद्युत ऋणात्मकता हाइड्रोजन से कम होती है, हाइड्रोजन के साथ संयुक्त होकर हाइड्राइड बनाते हैं, जैसे-NaH4 CaH2, AlH2 आदि। परन्तु वे द्विअंगी यौगिक, जिनमें हाइड्रोजन की विद्युत ऋणात्मकता धातु या अधातु से कम होती है, वे हाइड्रोजन ….. आइड कहलाते हैं जैसे H2S को हाइड्रोजन सल्फाइड और HCl को हाइड्रोजन क्लोराइड कहते हैं।
हाइड्राइडों का वर्गीकरण
हाइड्राइडों को उनमें उपस्थित आबन्ध की प्रकृति एवं तत्व जो हाइड्राइड बनाता है, की विद्युत ऋणात्मकता के आधार पर निम्नलिखित चार भागों में वर्गीकृत किया जा सकता है-
I. आयनिक अथवा लवणीय हाइड्राइड
प्रबल धनविद्युती तत्व जिनकी विद्युत-ऋणात्मकता का मान बहुत कम (<1.2) होता है, हाइड्रोजन के साथ संयुक्त होकर जो हाइड्राइड बनाते हैं, उन्हें आयनिक या लवणीय (लवण जैसे) हाइड्राइड कहते हैं। इन तत्वों के परमाणु अपने इलेक्ट्रॉनों का स्थानान्तरण हाइड्रोजन परमाणु को कर देते हैं। अत: इस प्रकार के हाइड्राइडों में हाईड्राइड आयन (H–) उपस्थित होता है। वर्ग 1 (IA) की क्षार धातु, वर्ग 2 (II A) की क्षारीय मृदा धातु और लैन्थेनम (La) इस प्रकार के हाइड्राइड बनाते हैं। इनका सामान्य सूत्र MHn होता है, जहाँ n धातु की वर्ग संख्या है।
II. सहसंयोजक अथवा आण्विक हाइड्राइड
वे तत्व जिनकी विद्युत ऋणात्मकता 2.0 से अधिक होती है, हाइड्रोजन के साथ संयुक्त होकर जो हाइड्राइड बनाते हैं, उन्हें प्रायः सहसंयोजक अथवा आण्विक हाइड्राइड कहते हैं। ऐसे हाइड्राइड मुख्यतः p-ब्लॉक के तत्व बनाते हैं। इनमें वर्ग 14, 15, 16 व 17 के अधातु तत्व प्रमुख हैं। इनके अतिरिक्त B s Al जैसे तत्व भी ये हाइड्राइड बनाते हैं। p-ब्लॉक के तत्व हाइड्रोजन के साथ इलेक्ट्रॉन के साझे द्वारा सहसंयोजक बन्ध बना लेते हैं। इनका सामान्य सूत्र XH (8-n) होता है, जहाँ n आवर्त सारणी में तत्व X की वर्ग संख्या है।
III. धात्विक अथवा अन्तराकाशी हाइड्राइड
अनेक संक्रमण तथा आन्तरिक संक्रमण धातुएँ और Be तथा Mg हाइड्रोजन को अपने जालक के अन्तराकाश में अवशोषित करके धातु जैसे हाइड्राइड जिन्हें अन्तराकाशी हाइड्राइड भी कहते हैं, बनाती हैं। ये धातुएँ हाइड्रोजन को अवशोषित कर लेती हैं। हाइड्रोजन परमाणु का आकार छोटा होने के कारण यह इन धातु जालकों के अन्त:कोशों में स्थान ग्रहण कर लेता है। इनका रासायनिक संघटन परिवर्तनशील होता है। इस कारण ये हाइड्राइड अरससमीकरणमितीय होते हैं। वर्ग 3, 4 और 5 की संक्रमण धातुएँ धात्विक हाइड्राइड बनाती हैं। वर्ग 6 में क्रोमियम भी एक हाइड्राइड बनाता है। इसके पश्चात् इसमें एक अन्तराल बन जाता है क्योंकि सातवें, आठवें तथा नौवें वर्ग की धातुएँ इस प्रकार के हाइड्राइड नहीं बनाती हैं। चूँकि इनके गुण मातृ धातु से मिलते हैं, अतः इन्हें धात्विक हाइड्राइड कहते हैं। इनमें हाइड्रोजन की न्यूनता के कारण लवणीय हाइड्राइडों के विपरीत ये सदैव अरससमीकरणमितीय होते हैं।
उदाहरण—LaH2.87, YbH2.55, TiH1.5-1.8, ZrH1.3-1.75, VH0.56 आदि। ऐसे हाइड्राइडों में स्थिर संघटन का नियम लागू नहीं होता है।
पूर्व में यह सोचा जाता था कि इन हाइड्राइडों के धातु जालक में हाइड्रोजन परमाणु अन्तराकाशी स्थिति ग्रहण करते हैं जिससे इनमें बिना किसी परिवर्तन के विकृति उत्पन्न हो जाती है। इसलिए इन्हें अन्तराकाशी हाइड्राइड कहा गया यद्यपि बाद में अध्ययन से यह स्पष्ट हुआ कि वर्ग 7, 8,9 (अथवा VIII वर्ग) के तत्व Fe, Co, Ni, Te, Ru, Rh, Re, Os तथा Ir के हाइड्राइड को छोड़कर अन्य हाइड्राइड अपने जनक धातु की तुलना में भिन्न जालक रखते हैं। इनको 150-400°C ताप पर धातु के साथ हाइड्रोजन के सीधे अवशोषण से या धातु ऑक्साइडों के विद्युत अपचयन द्वारा बनाया जा सकता है। धात्विक हाइड्राइड धातु से हल्के तथा विद्युत व ऊष्मा के अच्छे चालक होते हैं। इनमें धात्विक गुण होता है तथा इनकी अपचायक सामर्थ्य प्रबल होती है जो हाइड्रोजन की परमाण्वीय अवस्था को इंगित करती है। इनके घनत्व मातृ धातु के घनत्व से कम होते हैं क्योंकि अन्तराकाशीय हाइड्रोजन, धात्विक जालक को फैला देती है।
IV. बहुलकी या जटिल हाइड्राइड
Al, B, Be, Co, Ni तथा Cu (वे तत्व जिनकी विद्युत ऋणात्मकता 1.4 से 2.0 के मध्य होती है) के हाइड्राइड बहुलीकृत होकर बहुलक बनाते हैं क्योंकि इन हाइड्राइडों के केन्द्रीय परमाणु (धातु आयन) के संयोजी कोश में इलेक्ट्रॉनों का अष्टक पूर्ण नहीं होता, अर्थात् ये हाइड्राइड इलेक्ट्रॉन न्यून होते हैं या इनके धातु कोश जालक अपने अन्तराकाश में परमाण्वीय हाइड्रोजन को ही स्थान दे पाते हैं।
ऐसे हाइड्राइडों में दो या अधिक धातु परमाणु आपस में हाइड्रोजन सेतु द्वारा जुड़े रहते हैं। जैसे-(BeH2)n, (AlH3) तथा B2H6 आदि।
Be, Al व B के बहुलक हाइड्राइडों को सहसंयोजक हाइड्रोइड बनाने की विधियों द्वारा बनाया जा सकता है, जबकि Cu, Co तथा Ni के हाइड्राइड अन्तराकाशी हाइड्राइड बनाने की विधियों द्वारा बनाए जा सकते हैं।
बेरिलियम हाइड्राइड को BeCl2 की LiH से शुष्क ईथर की उपस्थिति में अभिक्रिया द्वारा बनाया जा सकता है।

बहुलक हाइड्राइड गर्म करने पर तत्वों में विघटित हो जाते हैं। इलेक्ट्रॉन न्यून हाइड्राइड MH–4 प्रकार के ऋणायन बनाते हैं (M = B, Be, Al)। ये अच्छे अपचायक होते हैं। इनकी संरचना इनमें उपस्थित तत्व की प्रकृति पर निर्भर करती है।

प्रश्न 2.
जल के प्रमुख भौतिक एवं रासायनिक गुणों का वर्णन कीजिए।
उत्तर
जले के प्रमुख भौतिक गुण निम्नवत् है
- शुद्ध जल एक पारदर्शक, रंगहीन तथा गंधहीन द्रव है।
- शुद्ध जल विद्युत का कुचालक है।
- ठण्डा करने पर जल का आयनन 4°C तक घटता है, फिर बढ़ने लगता है। 4°C पर जल का घनत्व उच्चतम होता है। जल 0°C पर जमकर बर्फ बनने लगता है। जिसमें इसका आयतन बढ़ता है। यही कारण है कि बर्फ जल से हल्की होती है।
- सामान्य वायुमण्डलीय दाब पर जल 100°C पर उबलता है।
- जल एक अच्छा विलायक है। इसका अति अल्प भाग स्वतः आयनन होता है
2H2O ⇌ H2O+ + OH–
जल की आयनन की मात्रा बहुत कम है। 250°C पर जल का आयनिक गुणनफल, Kw = 10×10-14 होता है। जल में H3O+ व H– आयनों की सान्द्रताएँ समान होती हैं।
जल उदासीन (pH = 7) द्रव है।।
- जल एक संगुणित द्रव है। इसमें अनेक H2O अणु हाइड्रोजन आबन्धों द्वारा एक-दूसरे से संगुणित होते हैं।
जल के प्रमुख रासायनिक गुण निम्नवत् हैं-




प्रश्न 3.
प्रयोगशाला में हाइड्रोजन परॉक्साइड बनाने की विधि का वर्णन कीजिए तथा इसके दो गुण एवं दो उपयोग लिखिए।
उत्तर
H2O2 बनाने की प्रयोगशाला विधि
प्रयोगशाला में हाइड्रोजन परॉक्साइड (H2O2) का निम्नलिखित विधियों द्वारा निर्माण किया जाता है–
1. सोडियम परॉक्साइड पर तनु H2SO4 की अभिक्रिया द्वारा-सोडियम परॉक्साइड (Na2O2) में हिमशीत सल्फ्यूरिक अम्ल के 20% विलयन को धीरे-धीरे मिलाने पर हाइड्रोजन परॉक्साइड और सोडियम सल्फेट बनता है। उत्पाद को ठण्डा करने पर Na2SO4.10H2O (ग्लोबर लवण) के क्रिस्टल पृथक् हो जाते हैं और विलयन में 30% H2O2 शेष रह जाता है।
Na2O2 + H2SO4→ Na2SO4 ↓ + H2O2
2. बेरियम परॉक्साइड पर H2SO4 की क्रिया द्वारा–ठण्डे जल में बनी बेरियमं परॉक्साइड की लेई में ठण्डा तथा तनु H2SO4 मिलाने पर बेरियम सल्फेट तथा H2O2 बनता है। BaSO4 के अवक्षेप को छानकर पृथक् करने पर H2O2 का तनु निस्यन्द प्राप्त होता है।
BaO2 + H2SO4 → BaSO4 ↓ + H2O2
3. मर्क विधि द्वारा—ठण्डे पानी में BaO2 मिलाकर CO2 प्रवाहित करने पर BaCO3 और H2O2 बनते हैं। BaCO3 को छानकर अलग कर लिया जाता है।
BaO2 + CO2 + H2O → BaCO3 ↓ + H2O2
H2O2 के रासायनिक गुण निम्नवत् हैं-
1. ऑक्सीकारक गुण-
H2O2 एक प्रबल ऑक्सीकारक है। यह PbS को PbSO4 में ऑक्सीकृत कर देता है।
PbS + 4H2O2 → 9 PbSO4 + 4H2O
2. विरंजक गुण-हाइड्रोजन परॉक्साइड अपने ऑक्सीकारक गुण के कारण विरंजक का कार्य करता है।
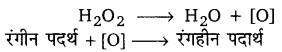
H2O2 के उपयोग निम्नवत् हैं-
- कीटाणुनाशक के रूप में, घाव, दाँत तथा कान को धोने में।
- क्लोरीनाशक के रूप में।
- विरंजक के रूप में।
प्रश्न 4.
हाइड्रोजन परॉक्साइड के औद्योगिक निर्माण की विधि का आवश्यक समीकरण देते हुए वर्णन कीजिए। इसका कम दाब पर आसवन के द्वारा सान्द्रण को चित्र द्वारा दर्शाकर समझाइए।
उत्तर
हाइड्रोजन परॉक्साइड के औद्योगिक निर्माण के लिए निम्नलिखित विधियाँ उपयोग में लायी जाती हैं।
1.H2SO4 के वैद्युत-अपघटन से-कम ताप पर 50% H2SO4 विलयन का एक बर्फ में रखी हुई सेल में प्लेटिनम ऐनोड तथा ग्रेफाइट कैथोड के मध्य अपघटन करने से कैथोड पर H2 और ऐनोड पर, पर-डाईसल्फ्यू रिक ऐसिड (H2S2O8) बनता है।

ऐनोड पर :
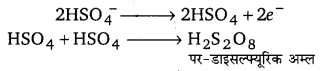
पर-डाइसल्फ्यूरिक अम्ल पर-डाइसल्फ्यूरिक अम्ल विलयन का अलग से जल-अपघटन करने से H2O2 बनता है।
H2S2O8 +2H2O → H2O2 +2H2SO4
कैथोड पर :
2H+ +2e– → H2 ↑
कम दाब तथा उच्च ताप पर आसवन करने पर H2O2 अलग हो जाती है। निर्वात् में प्रभाजी आसवन से H2O2 की सान्द्रता बढ़ जाती है।
2. अमोनियम हाइड्रोजन सल्फेट के वैद्युत-अपघटन से—उपर्युक्त विधि में H2SO4 के स्थान पर अमोनियम हाइड्रोजन सल्फेट के सान्द्र विलयन का वैद्युत-अपघटन करने से ऐनोड पर अमोनियम पर-डाइसल्फेट बनता है, जिसका H2SO4 के साथ आसवन करने पर H2O2 बनता है।

अमोनियम पर-डाइसल्फेट अमोनियम पर-डाइसल्फेट का सल्फ्यूरिक अम्ल में विलयन बनाकर उसका कम दाब और उच्च ताप पर आसवन करने से हाइड्रोजन परॉक्साइड का 30% विलयन प्राप्त होता है।
(NH4)2S2O8 + H2SO4 → H2S2O8 + (NH4)2SO4
H2S2O8 + H2O → H2SO5 + H2SO4
H2SO5 + H2O → H2O2 + H2SO4
कैथोड पर : 2H+ +e– → H2↑

H2O2 का सान्द्रण–विभिन्न विधियों से बनायी गयी H2O2 की सान्द्रता प्राय: 30% होती है। इसे 70°C तक गर्म करके 45% H2O2 प्राप्त किया जा सकता है, किन्तु इससे उच्च ताप पर इसके अपघटन
को रोकने के लिए 15 मिमी दाब तथा 70°C पर इसका आसवन किया जाता है जिससे 90% सान्द्रता का H2O2 मिलता है। जल की शेष 10% मात्रा को निर्वात् अवशोषक (vacuum desiccator) में सान्द्र H2SO4 के ऊपर वाष्पित करने पर लगभग 99% सान्द्रता का H2O2 मिलता है। शेष 1% जल को दूर करने के लिए इस H2O2 विलयन को ठोस CO2 तथा ईथर के हिम-मिश्रण में रखा जाता है जिससे H2O2 क्रिस्टल के रूप में पृथक् हो जाता है। इसको गर्म करके शुद्ध H2O2 प्राप्त कर लिया जाता है।

प्रश्न 5.
हाइड्रोजन परॉक्साइड की संरचना की व्याख्या कीजिए। 20 आयतन H2O2 की सान्द्रता ग्राम/लीटर में परिकलित कीजिए।
उत्तर
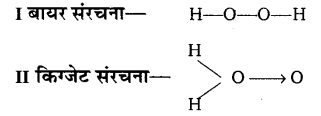
अणुभार निर्धारण एवं संघटनात्मक विश्लेषण के द्वारा हाइड्रोजन परॉक्साइड का सूत्र H2O2 ज्ञात किया गया है।
H2O2 की निम्नलिखित दो संरचनाएँ सम्भव हैं।


We hope the UP Board Solutions for Class 11 Chemistry Chapter 9 Hydrogen (हाइड्रोजन) help you. If you have any query regarding UP Board Solutions for Class 11 Chemistry Chapter 9 Hydrogen (हाइड्रोजन), drop a comment below and we will get back to you at the earliest.