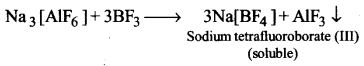
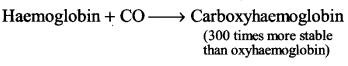
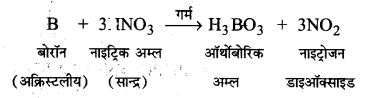
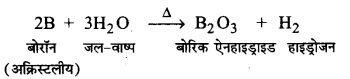
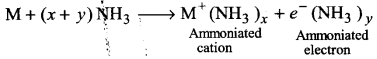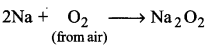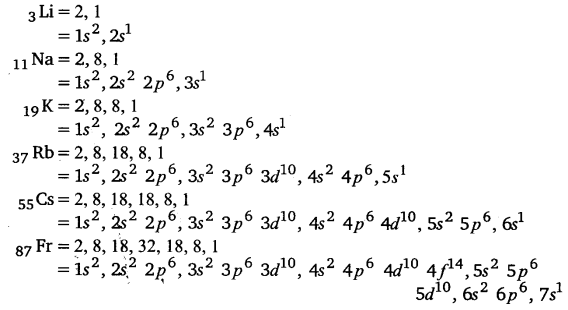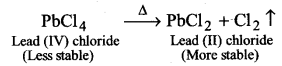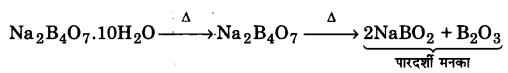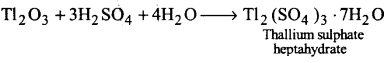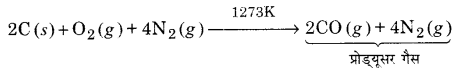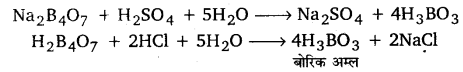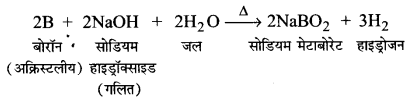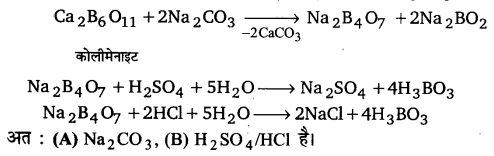UP Board Solutions for Class 11 Chemistry Chapter 10 The s-block Elements (s-ब्लॉक तत्त्व)
These Solutions are part of UP Board Solutions for Class 11 Chemistry. Here we have given UP Board Solutions for Class 11 Chemistry Chapter 10 The s-block Elements (s-ब्लॉक तत्त्व).
पाठ के अन्तर्गत दिए गए प्रश्नोत्तर
प्रश्न 1.
क्षार धातुओं के सामान्य भौतिक तथा रासायनिक गुण क्या हैं?
उत्तर
वर्ग 1 के तत्व: क्षार धातुएँ (Elements of Group 1: Alkali Metals) क्षार धातुओं के भौतिक तथा रासायनिक गुणों में परमाणु क्रमांक के साथ एक नियमित प्रवृत्ति पाई जाती है। इन तत्वों के भौतिक तथा रासायनिक गुणों की व्याख्या निम्नलिखित है-
भौतिक गुण (Physical Properties)
क्षार धातु-परिवार के सदस्यों के महत्त्वपूर्ण भौतिक गुण निम्नलिखित सारणी में सूचीबद्ध हैं।
सारणी-1: क्षार धातुओं के भौतिक गुण (Physical Properties of the Alkali Metals)
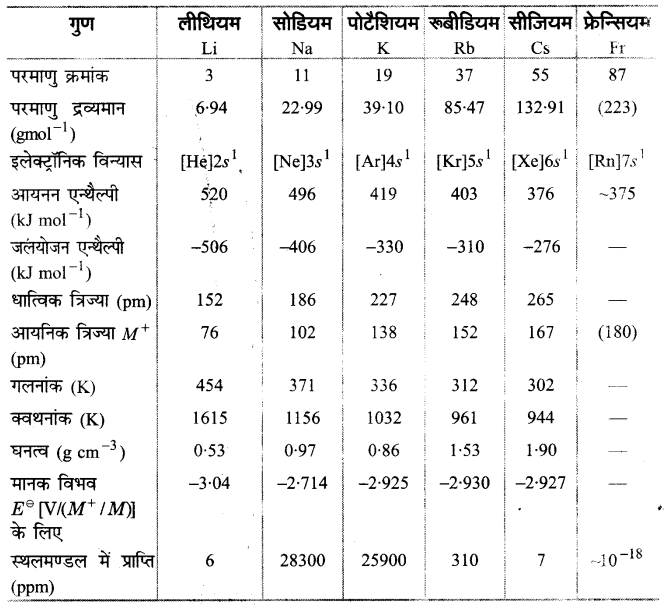
1. परमाणु त्रिज्या (Atomic radi)–क्षार धातुओं की परमाणु त्रिज्या ( धात्विक त्रिज्या) का मान अपने आवर्ती में सबसे अधिक होता है तथा ये मान वर्ग में नीचे जाने पर बढ़ते जाते हैं।
किसी परमाणु के नाभिक के केन्द्र से संयोजकता कोश में उपस्थित बाह्यतम इलेक्ट्रॉन के बीच की दूरी परमाणु त्रिज्या कहलाती है। क्षार धातुएँ, आवर्त का प्रथम तत्व होते हुए, सर्वाधिक परमाणु त्रिज्या रखती हैं, चूंकि इनके संयोजकता कोश में केवल एक इलेक्ट्रॉन होता है। परिणामस्वरूप नाभिक के साथ आकर्षण बल का परिमाण न्यूनतम होता है। वर्ग में नीचे जाने पर इलेक्ट्रॉन क्रोशों की क्ररि वृद्धि के कारण परमाणु त्रिज्या बढ़ती है। इसके अतिरिक्त वर प्रभाव का परिमाण भी बढ़ता है जो परमाणु के नाभिक के साथ संयोजी -इलेक्ट्रॉनों के आकर्षण को कम कर देता है, इसके – नाभिकीय आवेश भी बढ़ता है जो नाभिक तथा इलेक्ट्रॉनों के मध्य आकर्षण को बढ़ा देता है। परन्तु इसका परिमाण आवरण प्रभाव की तुलना में अत्यन्त कम होता है। इस प्रकार परमाणु आकार पर कुल परिमाण द्वारा यह प्रेक्षित होता है कि वर्ग में नीचे जाने पर तत्वों के परमाणु आकार बढ़ते हैं।
2. आयनिक त्रिज्या (Ionic radii)-क्षार धातु परमाणु संयोजी s (ns’)-इलेक्ट्रॉन खोकर एकलसंयोजी धनायन बनाते हैं। ये धनायनी त्रिज्या मूल परमाणु की तुलना में छोटी होती हैं। सारणी-3 के अनुसार आयनिक त्रिज्या के मान वर्ग में नीचे जाने पर बढ़ते हैं। चूंकि एकल संयोजी धनायनों का निर्माण परमाणु के संयोजकता कोश में उपस्थित केवल एक इलेक्ट्रॉन के निष्कासन पर होता है; अतः शेष इलेक्ट्रॉन परमाणु के नाभिक द्वारा अधिक आकर्षित होकर उसके समीप हो जाते हैं। परिणामस्वरूप धनायनों का आकार कम हो जाता है। जैसा कि आयनों का आकार अपने मूल परमाणुओं से सम्बद्ध होता है; इसलिए आयनिक त्रिज्या भी परमाणु त्रिज्या के समान वर्ग में नीचे जाने पर बढ़ती है।
3. आयनन एन्थैल्पी (lonisation enthalpies)-गैसीय अवस्था में किसी उदासीन विलगित परमाणु से सर्वाधिक शिथिल बद्ध (loosely bound) इलेक्ट्रॉन हटाने के लिए आवश्यक ऊर्जा को न्यूनतम मात्रा, आयनन एन्थैल्पी कहलाती है। इसे kJ mol-1 या ev इकाइयों में व्यक्त किया जा सकता है।
1eV = 96.472 kJ mol-1
क्षार धातुओं की आयनन एन्थैल्पी अपने आवर्ती में न्यूनतम होती है तथा वर्ग में नीचे जाने पर यह घटती है। इन तत्वों के प्रथम आयनन ऊर्जा के मान सारणी-1 में दिए गए हैं ।
क्षार धातुओं की आयनन एन्थैल्पी के मान कम होने का कारण इनका परमाणु आकार अधिक होना है। जिसके कारण संयोजी -इलेक्ट्रॉन (ns’) को सरलता से निकाला जा सकता है। आयनन एन्थैल्पी के मान वर्ग में नीचे जाने पर भी घटते हैं; क्योंकि परमाणु त्रिज्या के बढ़ने तथा आवर! प्रभाव को परिमाण अधिक होने पर नाभिक के आकर्षण बल का परिमाण घट जाता है। इसके अतिरिक्त एक ही तत्व के लिए प्रथम तथा द्वितीय आयनन एन्थैल्पी के मानों में बहुत अधिक अन्तर होता है।
उदाहरणार्थ-सोडियम के लिए प्रथम आयनन एन्थैल्पी का मान 496 kJ mol-1 है, जबकि इसकी द्वितीय आयनन एन्थैल्पी का मान 4562 kJmol-1 है। इसका प्रमुख कारण है कि एक इलेक्ट्रॉन खोकर बनने वाला एकल संयोजी धनायन (M+) उच्च सममिताकार तथा समीपवर्ती उत्कृष्ट गैस की स्थायी संरचना को प्राप्त कर लेता है। परिणामस्वरूप दूसरे इलेक्ट्रॉन का निष्कासन अत्यन्त कठिन प्रक्रिया हो जाती है जैसा कि उपर्युक्त उदाहरण में दिए सोडियम के प्रथम तथा द्वितीय आयनन एन्थैल्पी के मानों से स्पष्ट हो जाता है।
4. विद्युत ऋणात्मकता (Electronegativity)–किसी तत्व की विद्युत ऋणात्मकता इसके परमाणु की इलेक्ट्रॉनों (बन्ध के साझे युग्म के लिए) को अपनी ओर आकर्षित करने की क्षमता को कहते हैं। क्षार धातुओं की विद्युत ऋणात्मकता कम होती है जिसका अर्थ है कि इनकी इलेक्ट्रॉन आकर्षित करने की क्षमता कम होती है। विद्युत ऋणात्मकता के मान वर्ग में नीचे जाने पर घटते हैं।
क्षार धातु परमाणुओं का ns1 इलेक्ट्रॉनिक विन्यास होता है जिसका अर्थ है कि इनको प्रवृत्ति इलेक्ट्रॉन त्यागने की होती है न कि ग्रहण करने की। अतः इनकी विद्युत ऋणात्मकता के मान कम होते हैं। चूंकि वर्ग में नीचे जाने पर परमाणु आकार बढ़ते हैं; अतः परमाणु की संयोजी इलेक्ट्रॉन को थामे रखने की क्षमता में क्रमिक कमी आती है। इसलिए वर्ग में नीचे जाने पर विद्युत ऋणात्मकता घटती है।
5. ऑक्सीकरण-अवस्था एवं धन विद्युती गुण (Oxidation states and electropositive characters)–क्षार धातु परिवार के सभी सदस्य अपने यौगिकों में +1 ऑक्सीकरण अवस्था प्रदर्शित करते हैं तथा प्रबल धन विद्युती होते हैं। वर्ग में ऊपर से नीचे जाने पर धन विद्युती गुण बढ़ता है। क्षार धातुओ की आयनन एन्थेपी के भान बहुत कम होने के कारण इनके परमाणुओं में संयोजी इलेक्ट्रॉन खोकर एकल संयोजी धनायन बनाने की प्रवृत्ति बहुत अधिक होती है। परिमाणस्वरूप एन्थैल्पी का मान घटता है; अत: धन विद्युती गुण बढ़ता है।

6. धात्विक लक्षण (Metallic character)- वर्ग 1 के तत्व प्रारूपिक धातुएँ हैं तथा अत्यन्त कोमल हैं। इन्हें चाकू द्वारा सरलता से काटा जा सकता है। वर्ग में ऊपर से नीचे जाने पर इनके धात्विक लक्षणों में अत्यधिक वृद्धि होती है।
किसी तत्व का धात्विक गुण उसके इलेक्ट्रॉन त्यागकर धनायन बनाने की प्रवृत्ति से सम्बन्धित होता है। धात्विक बन्ध की प्रबलता इलेक्ट्रॉन समुद्र (electron sea) में उपस्थित संयोजी इलेक्ट्रॉनों तथा करनेल (kernal) के मध्य आकर्षण बल पर निर्भर करती है। करनेल का आकार जितना छोटा होगा तथा संयोजी इलेक्ट्रॉनों की संख्या जितनी अधिक होगी, धात्विक बन्ध उतना ही प्रबल होगा। दूसरे शब्दों में, धातु की कठोरता धात्विक बन्ध के प्रबल होने पर अधिक होगी। क्षार धातुओं में करनेल बड़े आकार के होते हैं तथा इनमें केवल एक संयोजी इलेक्ट्रॉन होता है। अतः क्षार धातुओं में धात्विक बन्ध दुर्बल होते हैं तथा क्षार धातुएँ कोमल होती हैं। लीथियम सबसे कठोर होता है, चूंकि इसका करनेल सबसे छोटे आकार का होता है।
7. गलनांक तथा क्वथनांक (Melting and boiling points)-क्षार धातुओं के गलनांक तथा क्वथनांक अत्यन्त कम होते हैं जो वर्ग में ऊपर से नीचे जाने पर घटते हैं।
क्षार धातुओं के परमाणुओं को आकार ‘अधिक होता है; अतः क्रिस्टल-जालक में इनकी बन्धन ऊर्जा बहुत कम होतो है। परिणामस्वरूप इनके गलनांक कम होते हैं। वर्ग में नीचे जाने पर परमाणु आकार में वृद्धि के साथ-साथ गलनांक के मान घटते हैं। क्वथनांक कम होने का कारण भी यही होता है।
8. घनत्व (Density)-क्षार धातुएँ अत्यन्त हल्की होती हैं। इस परिवार के पहले तीन सदस्य जल से भी हल्के होते हैं। वर्ग में ऊपर से नीचे जाने पर घनत्व बढ़ता है।
क्षार धातुओं के परमाणुओं का आकार बड़ा होता है; अत: वे अन्तराकाश में अधिक संकुलित (closely packed) नहीं होते हैं तथा इनका घनत्व कम होता है। वर्ग में ऊपर से नीचे जाने पर परमाणु आकार बढ़ने के कारण घनत्व कम होना चाहिए; परन्तु यह बढ़ता है। चूंकि परमाणु आकार के साथ-साथ परमाणु भार भी बढ़ता है जिसका प्रभाव अधिक है; अत: घनत्व (भार/आयतन) वर्ग में नीचे जाने पर। बढ़ता है। इसका एक अपवाद पोटेशियम (K) हैं जिसका घनत्व सोडियम से कम है। इसका मुख्य कारण पोटेशियम के परमाणु आकार तथा परमाणु आयतन में असामान्य वृद्धि है।
9. जलयोजन एन्थैल्पी (Hydration enthalpy)-जलयोजन एन्थैल्पी (A Hd ) वह ऊर्जा है जो जलीय विलयन में आयनों के जलयोजित होने पर मुक्त होती है। क्षार धातु आयनों की जलयोजन एन्थैल्पी निम्नलिखित क्रम में होती है-
Li+ > Na+ >K+ > Rb+ >Cs+
जलयोजन में आयनों तथा चारों ओर उपस्थित जल अणुओं के मध्य आकर्षण होता है। अतः आयन का आकार छोटा होने पर, इस पर आवेश का परिमाण अधिक होगा तथा इनकी जलयोजित होने की क्षमता उतनी ही अधिक होगी। क्षार धातुओं में Li+ आयन की जलयोजन एन्थैल्पी सर्वाधिक होती है। इसलिए लीथियम के लवण अधिकतर जलयोजी प्रवृत्ति के होते हैं (LiC1.2H2O)।
10. ज्वाला में रंग देना (Colouration to the flame)-क्षार धातुओं के यौगिकों (मुख्य रूप से क्लोराइड) को प्लैटिनम के तार पर गर्म करने पर ये ज्वाला को विशिष्ट रंग प्रदान करते हैं।
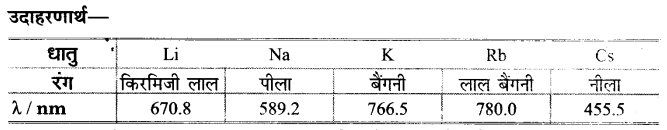
चूँकि क्षार धातुओं की आयनन एन्थैल्पी बहुत कम होती है; अत: इनके इलेक्ट्रॉनों को उच्च ऊर्जा स्तर तक उत्तेजित करना सरल होता है। जब इन धातुओं को प्लैटिनम की तार पर रखकर ज्वाला दी जाती है। तो ज्वाला की ऊर्जा से इलेक्ट्रॉन नाभिक से दूर उच्च ऊर्जा स्तर पर पहुँच जाते हैं। पुनः जब ये उत्तेजित इलेक्ट्रॉन उच्च ऊर्जा स्तर से निम्न ऊर्जा स्तर पर आते हैं तो विकिरण के रूप में दृश्य प्रकाश उत्सर्जित करते हैं। फलस्वरूप क्षार धातुएँ ज्वाला को विशिष्ट रंग प्रदान करती हैं।
11. प्रकाश-विद्युत प्रभाव (Photoelectric effect)-लीथियम के अतिरिक्त सभी क्षार धातुएँ प्रकाश-विद्युत प्रभाव प्रदर्शित करती हैं। प्रकाश-विद्युत प्रभाव को इस प्रकार परिभाषित किया जा सकता है–“जब किसी धातु की सतह पर निश्चित आवृत्ति की किरणें टकराती हैं तो धातु की सतह से इलेक्ट्रॉन उत्सर्जित होकर निकलते हैं। इसे प्रकाश-विद्युत प्रभाव कहते हैं। दूसरे शब्दों में, धातु की सतह पर फोटॉन के प्रहार से इलेक्ट्रॉनों का उत्सर्जन प्रकाश-विद्युत प्रभाव कहलाता है।
प्रकाश-विद्युत प्रभाव का कारण क्षार धातुओं की न्यूनतम आयनन एन्थैल्पी है। धातु की सतह पर गिरने वाले फोटॉनों के पास इतनी ऊर्जा होती है कि वे इलेक्ट्रॉनों को धातु की सतह से उत्सर्जित कर देते हैं। चूंकि लीथियम के छोटे आकार के कारण इसकी आयनन ऊर्जा अधिक होती है; अतः इस धातु पर गिरने वाला फोटॉन नाभिक और, इलेक्ट्रॉनों के बीच आकर्षण बल को कम करने में सक्षम नहीं होता है। इस प्रकार प्रकाश के.दृश्य क्षेत्र में यह धातु प्रकाश-विद्युत प्रभाव प्रदर्शित नहीं करती।
रासायनिक गुण (Chemical Preperties)
क्षार धातुएँ बड़े आकार तथा कर्म आयनन एन्थैल्पी के कारण अत्यधिक क्रियाशील होती हैं। इनकी क्रियाशीलता वर्ग में ऊपर से नीचे क्रमशः बढ़ती जाती है। इस वर्ग के सदस्यों के महत्त्वपूर्ण रासायनिक गुण निम्नलिखित हैं-
1. वायु के साथ अभिक्रियाशीलता (Reactivity with air)-क्षार धातुएँ वायु की उपस्थिति में मलिन (exposed) हो जाती हैं; क्योकि वायु की उपस्थिति में इन पर ऑक्साइड तथा हाइड्रॉक्साइड की पर्त बन जाती है। ये ऑक्सीजन में तीव्रता से जलकर ऑक्साइड बनाती हैं। लीथियम और सोडियम क्रमशः मोनोक्साइड तथा परॉक्साइड का निर्माण करती हैं, जबकि अन्य धातुओं द्वारा सुपर ऑक्साइड आयन का निर्माण होता है। सुपर ऑक्साइड 0,- बड़े धनायनों; जैसे-K’, RB’ तथा Cs’ की उपस्थिति में स्थायी होता है।
4Li+O2 → 2Li2O (ऑक्साइड)
2Na +O2 → Na2O2 (परॉक्साइड)
M+O2 → MO2 (सुपर ऑक्साइड) (M =K, Rb, Cs)
इन सभी ऑक्साइडों में क्षार की ऑक्सीकरण अवस्था +1 होती है। लीथियम अपवादस्वरूप वायु में उपस्थित नाइट्रोजन से अभिक्रिया करके नाइट्राइड, LisN बना लेता है। इस प्रकार लीथियम भिन्न स्वभाव दर्शाता है। क्षार धातुओं को वायु एवं जल के प्रति उनकी अति सक्रियता के कारण साधारणतया रासायनिक रूप से अक्रिय विलायकों; जैसे-किरोसिन में रखा जाता है।
2. जल के साथ अभिक्रियाशीलता (Reactivity with water)-क्षार धातुएँ, इनके ऑक्साइड, परॉक्साइड तथा सुपर ऑक्साइड भी जल के साथ अभिक्रिया करके हाइड्रॉक्साइड, जो घुलनशील होते हैं तथा क्षार (alkalies) कहलाते हैं, बनाती हैं।
2Na + 2H2O → 2Na+ + 2OH– +H2
Li2O+H2O → 2LiOH
Na2O2 + 2H2O → 2NaOH +H2O2
2KO2 + 2H2O → 2KOH + H2O2 +O2 ↑
यद्यपि लीथियम के मानक इलेक्ट्रोड विभव (E⊖) का मान अधिकतम ऋणात्मक होता है, परन्तु जल के साथ इसकी अभिक्रियाशीलता सोडियम की तुलना में कम है, जबकि सोडियम के E⊖] का मान अन्य क्षार धातुओं की अपेक्षा न्यून ऋणात्मक होता है। लीथियम के इस व्यवहार का कारण इसके छोटे आकार तथा अत्यधिक जलयोजन ऊर्जा का होना है। अन्य क्षार धातुएँ जल के साथ विस्फोटी अभिक्रिया करती हैं। चूँकि अभिक्रिया उच्च ऊष्माक्षेपी होती है तथा विमुक्त होने वाली हाइड्रोजन आग पकड़ लेती है, इसलिए क्षार धातुओं को जल के सम्पर्क में नहीं रखते। क्षार धातुएँ प्रोटॉनदाता (जैसे-ऐल्कोहॉल, गैसीय अमोनिया, ऐल्काइन आदि) से भी अभिक्रियाएँ करती हैं।
3. डाईहाइड्रोजन से अभिक्रियाशीलता (Reactivity with dihydrogen)—लगभग 673K (लीथियम के लिए 1073K) पर क्षार धातुएँ डाइहाइड्रोजन से अभिक्रिया कर हाइड्राइड बनाती हैं। सभी क्षार धातुओं के हाइड्राइड रंगहीन, क्रिस्टलीय एवं आयनिक होते हैं। इन हाइड्राइडों के गलनांक उच्च होते हैं।

हाइड्राइडों का आयनिक गुण Li से Cs तक बढ़ता है। क्षार धातुओं की कम आयनन एन्थैल्पी के कारण इनके परमाणु सरलता से संयोजी इलेक्ट्रॉन खोकर आयनिक हाइड्राइड (M+H–) बनाते हैं। चूंकि आयनन एन्थैल्पी वर्ग में ऊपर से नीचे जाने पर घटती है; अतः धनात्मक आयन बनाने की प्रवृत्ति उसी अनुसार बढ़ती है। इसलिए हाइड्रोइडों का आयनिक गुण भी बढ़ता है।
4. हैलोजेन से अभिक्रियाशीलता (Reactivity with halogens)-क्षार धातुएँ हैलोजेन से शीघ्र प्रबल अभिक्रिया करके आयनिक ऑक्साइड हैलाइड M+X– बनाती हैं।
2M+X2 → 2M+ X–
यद्यपि लीथियम के हैलाइड आंशिक रूप से सहसंयोजक होते हैं। इसका कारण लीथियम की उच्च ध्रुवण-क्षमता है। (धनायन के कारण ऋणायन के इलेक्ट्रॉन अभ्र का विकृत होना ‘ध्रुवणता (polarisation) कहलाता है।) लीथियम आयन का आकार छोटा है; अत: यह हैलाइड आयन के इलेक्ट्रॉन अभ्र को विकृत करने की अधिक क्षमता दर्शाता है। चूंकि बड़े आकार का ऋणायन आसानी से विकृत हो जाता है, इसलिए लीथियम आयोडाइड सहसंयोजक प्रकृति सबसे अधिक दर्शाते हैं। अन्य क्षार धातुएँ आयनिक प्रवृत्ति की होती हैं। इनके गलनांक तथा क्वथनांक उच्च होते हैं। गलित हैलाइड विद्युत के सुचालक होते हैं। इनका प्रयोग क्षार धातुएँ बनाने में किया जाता है।
5. अपचायक प्रकृति (Reducing nature)-क्षार धातुएँ प्रबल अपचायक के रूप में कार्य करती हैं। जिनमें लीथियम प्रबलतम एवं सोडियम दुर्बलतम अपचायक है। मानक इलेक्ट्रोड विभव (E⊖), जो अपचायक क्षमता का मापक है, सम्पूर्ण परिवर्तन का प्रतिनिधित्व करता है-
M(s) → M(g) ऊर्ध्वपातन एन्थैल्पी
M(g) → M+(g) + e– आयनन एन्थैल्पी
M+ (g) + H22O → M+ (aq) जलयोजन एन्थैल्पी
स्पष्ट है कि E⊖ का मान जितना कम होगा अपचायक गुण उतना ही अधिक होगा। लीथियम आयन का आकार छोटा होने के कारण इसकी जलयोजन एन्थैल्पी का मान अधिकतम होता है, जो इसके उच्च ऋणात्मक E⊖ मान तथा इसके प्रबल अपचायक होने की पुष्टि करता है।
6. द्रव अमोनिया में विलयन (Solution in liquid ammonia)-क्षार धातुएँ द्रव अमोनिया में घुलनशील हैं। अमोनिया में इनके विलयन का रंग गहरा नीला होता है एवं विलयन प्रकृति में विद्युत का सुचालक होता है।
M+(x+ y)NH3 → [M(NH3)x]+ + [NH3)y]–
विलयन का नीला रंग अमोनीकृत इलेक्ट्रॉनों के कारण होता है, जो दृश्य प्रकाश क्षेत्र की संगत ऊर्जा का अवशोषण करके विलयन को नीला रंग प्रदान करते हैं। अमोनीकृत विलयन अनुचुम्बकीय (paramagnetic) होता है, जो कुछ समय पड़े रहने पर हाइड्रोजन को मुक्त करता है। फलस्वरूप, विलयन में ऐमाइड बनता है।
M+ (am) +e– +NH3(2) → MNH2 (am) + 1/2H2(g)
जहाँ ‘am’ अमोनीकृत विलयन दर्शाता है। सान्द्र विलयन में नीला रंग ब्रॉन्ज रंग में बदल जाता है और विलयन प्रतिचुम्बकीय (diamagnetic) हो जाता है।
7. सल्फर तथा फॉस्फोरस के साथ अभिक्रिया (Reaction with sulphur and phosphorus)- क्षार धातुएँ सल्फर तथा फॉस्फोरस से गर्म करने पर अभिक्रिया करके सम्बन्धित सल्फाइड तथा फॉस्फाइड बनाती हैं।
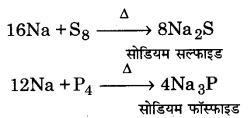
सोडियम फॉस्फाइड सल्फाइड तथा फॉस्फाइड दोनों जल द्वारा जल-अपघटित हो जाते हैं।

प्रश्न 2.
क्षारीय मृदा धातुओं के सामान्य अभिलक्षण एवं गुणों में आवर्तिता की विवेचना कीजिए।
उत्तर
वर्ग 2 के तत्व: क्षारीय मृदा धातुएँ (Elements of Group2:Alkaline Earth Metals) आवर्त सारणी के वर्ग 2 के तत्वं हैं-बेरिलियम (Be), मैग्नीशियम (Mg), कैल्सियम (Ca), स्ट्रॉन्शियम (Sr), बेरियम (Ba) एवं रेडियम (Ra)। बेरिलियम के अतिरिक्त अन्य तत्व संयुक्त रूप से ‘मृदा धातुएँ’ कहलाती हैं। प्रथम तत्व बेरिलियम वर्ग के अन्य तत्वों से भिन्नता दर्शाता है एवं ऐलुमिनियम के साथ विकर्ण सम्बन्ध (diagonal relationship) दर्शाता है। वर्ग का अन्तिम तत्व रेडियम रेडियोऐक्टिव प्रकृति का है। इन तत्वों को विशिष्ट नाम निम्नलिखित कारणों से दिया जाता है-
- इन तत्वों के ऑक्साइड क्षार धातुओं के समान जल में घुलकर हाइड्रॉक्साइड अथवा क्षार बनाते हैं।
- ‘मृदा’ नाम इन्हें इसलिए दिया गया; क्योंकि ऐलुमिना (Al2O3) जैसे पदार्थ ऊष्मा के प्रति अधिक स्थायी होते हैं। कैल्सियम, स्ट्रॉन्शियम तथा बेरियम के ऑक्साइड भी ऊष्मा के प्रति स्थायी होते हैं तथा अत्यधिक गर्म किए जाने पर भी अपघटित नहीं होते। ये धातु ऑक्साइड तथा
धातुएँ भी क्षारीय मृदा कहलाती हैं।
इलेक्ट्रॉनिक विन्यास (Electronic Configuration)
इन तत्वों के संयोजकता-कोश के s-कक्षक में 2 इलेक्ट्रॉन होते हैं। इनका सामान्य इलेक्ट्रॉनिक विन्यास [उत्कृष्ट गैस]ns2 होता है। क्षार धातुओं के समान ही इनके यौगिक भी मुख्यत: आयनिक प्रकृति के होते हैं।


क्षारीय मृदा धातुओं के सामान्य अभिलक्षण तथा गुणों में आवर्तिता इनके भौतिक तथा रासायनिक गुणों से स्पष्ट होती है। इनकी विवेचना निम्नवत् है-
भौतिक गुण (Physical Properties)
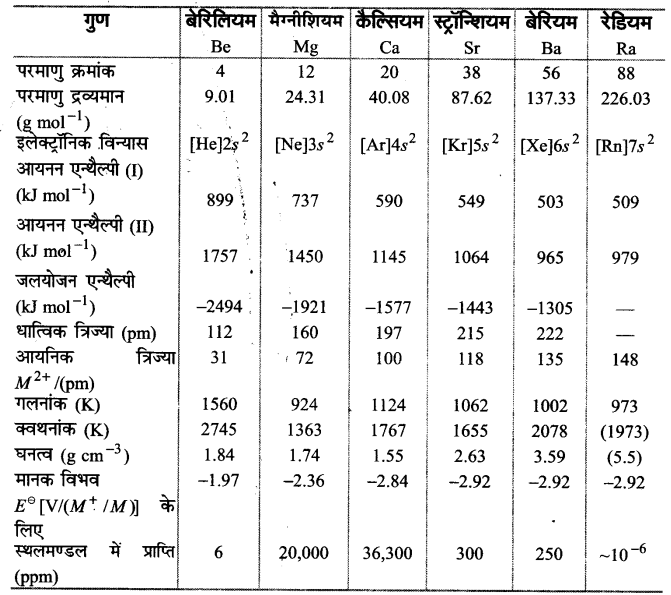
क्षारीय मृदा धातु-परिवार के सदस्यों के महत्त्वपूर्ण भौतिक गुण सारणी-2 में सूचीबद्ध हैं। इनका संक्षिप्त विवरण निम्नलिखित है-
1. परमाण्वीय एवं आयनिक त्रिज्या (Atomic and ionic radii)-आवर्त सारणी के संगत आवर्ती में क्षार धातुओं की तुलना में क्षारीय मृदा धातुओं की परमाण्वीय एवं आयनिक त्रिज्याएँ छोटी होती हैं। ये वर्ग में ऊपर से नीचे जाने पर बढ़ती हैं। इसका कारण इन तत्वों के नाभिकीय आवेशों में वृद्धि होना
2. आयनन एन्थैल्पी (lonisation enthalpies)-क्षारीय मृदा धातुओं के परमाणुओं के बड़े आकार के कारण इनकी आयनने एन्थैल्पी के मान न्यून होते हैं। चूंकि वर्ग में आकार ऊपर से नीचे क्रमश: बढ़ता जाता है; अत: इनकी आयनन एन्थैल्पी के मान कम होते जाते हैं जैसा कि सारणी-2 में स्पष्ट है। क्षारीय मृदा धातुओं के प्रथम आयनन एन्थैल्पी का मान क्षार धातुओं के प्रथम आयनन एन्थैल्पी के मानों की तुलना में अधिक है। यह इनकी क्षार धातुओं की संगत तुलनात्मक रूप से छोटे आकार होने के कारण होती है, परन्तु इनके द्वितीय आयनन एन्थैल्पी के मान क्षार धातुओं के द्वितीय आयनन एन्थैल्पी के मानों की तुलना में कम हैं। उदाहरणार्थ-Mg के प्रथम यिनन एन्थैल्पी को मान Na से अधिक है जिसका कारण Mg का छोटा आकार तथा सममित्ताकार इलेक्ट्रॉनिक विन्यास है। परन्तु एक इलेक्ट्रॉन खोकर Na+ आयन उत्कृष्ट गैस निऑन को विन्यास (1s2,2s2 2p6) प्राप्त कर लेता है, जबकि Mg के संयोजकता कोश में अभी भी एक इलेक्ट्रॉन शेष रह जाता है (1s2,2s2 2p6, 3s1)। सोडियम के द्वितीयक आयनन एन्थैलपी का उच्च मान इसके सममिताकार इलेक्ट्रॉनिक विन्यास के कारण होता है।
3. जलयोजन एन्थैल्पी (Hydration enthalpy)-क्षार धातुओं के समान इसमें भी वर्ग में ऊपर से नीचे आयनिक आकार बढ़ने पर इनकी जलयोजन एन्थैल्पी के मान कम होते जाते हैं।
Be2+ > Mg2+ >Ca2+ >Sr2+ > Ba2+
क्षारीय मृदा धातुओं की जलयोजन एन्थैल्पी क्षार धातुओं की जलयोजन एन्थैल्पी की तुलना में अधिक होती है। इसीलिए मृदा धातुओं के यौगिक क्षार धातुओं के यौगिकों की तुलना में अधिक जलयोजित होते हैं। जैसे–MgCl2 एवं CaCl2 जलयोजित अवस्था MgCl2.6H2O एवं CaCl2.6H2O में पाए जाते हैं, जबकि NaCl एवं KCI ऐसे हाइड्रेट नहीं बनाते हैं।
4. धात्विक गुण (Metallic character)-क्षारीय मृदा धातुएँ सामान्यतया चाँदी की भाँति सफेद, चमकदार एवं नर्म, परन्तु अन्य धातुओं की तुलना में कठोर होती हैं। बेरिलियम तथा मैग्नीशियम लगभग धूसर रंग (greyish) के होते हैं। क्षारीय मृदा धातुओं में समान आवर्त में उपस्थित क्षार धातुओं की तुलना में प्रबल धात्विक बन्ध होते हैं। उदाहरणार्थ-मैग्नीशियम, सोडियम की तुलना में अधिक कठोर तथा सघन होता है।
5. गलनांक तथा क्वथनांक: (Melting and boiling points)–इनके गलनांक एवं क्वथनांक क्षार धातुओं की तुलना में उच्च होते हैं; क्योंकि इनके आकार छोटे होने के कारण ये निविड संकुलित (closely packed) होते हैं तथा इनमें प्रबल धात्विक बन्ध होते हैं। फिर भी इनके गलनांकों तथा क्वथनांकों में कोई नियमित परिवर्तन नहीं दिखता है।
6. धनविद्युती गुण (Electropositive character)–निम्न आयनन एन्थैल्पी के कारण क्षारीय मृदा धातुएँ प्रबल धनविद्युती होती हैं। धनविद्युती गुण ऊपर से नीचे Be से Ba तक बढ़ता है।
7. ज्वाला को रंग प्रदान करना (Colouration to the flame)-कैल्सियम, स्ट्रॉन्शियमं एवं बेरियम ज्वाला को क्रमशः ईंट जैसा लाल (brick red) रंग, किरमिजी लाल (crimson red) एवं हरा (apple’. green) रंग प्रदान करते हैं। ज्वाला में उच्च ताप पर वाष्प-अवस्था में क्षारीय मृदा धातुओं के बाह्यतम कोश के इलेक्ट्रॉन उत्तेजित होकर उच्च ऊर्जा-स्तर पर चले जाते हैं। ये उत्तेजित इलेक्ट्रॉन जब पुन: अपनी तलस्थ अवस्था में लौटते हैं, तब दृश्य प्रकाश के रूप में ऊर्जा उत्सर्जित होती है। परिणामस्वरूप ज्वाला रंगीन दिखने लगती है। बेरिलियम तथा मैग्नीशियम के बाह्यतम कोशों के इलेक्ट्रॉन इतनी प्रबलता से बँधे रहते हैं कि ज्वाला की ऊर्जा द्वारा इनका उत्तेजित होना कठिन हो जाता है। अतः ज्वाला में इन धातुओं का अपना कोई अभिलाक्षणिक रंग नहीं होता है। गुणात्मक विश्लेषण में Ca, Sr एवं Ba मूलकों की पुष्टि ज्वाला-परीक्षण के आधार पर की जाती है तथा इनकी सान्द्रता का निर्धारण ज्वाला प्रकाशमापी द्वारा किया जाता है। क्षारीय मृदा धातुओं की क्षार धातुओं की तरह विद्युत एवं ऊष्मीय चालकता उच्च होती है। यह इनका अभिलाक्षणिक गुण होता है।
सारणी-2 : क्षारीय मृदा धातुओं के परमाण्वीय एवं भौतिक गुण (Atomic and Physical Properties of the Alkaline Earth Metals)
8. विद्युत-ऋणात्मकता (Electronegativity)-क्षारीय मृदा धातुओं के विद्युत-ऋणात्मकता मान क्षार धातुओं के लगभग समान होते हैं (कुछ अधिक)। विद्युत-ऋणात्मकता मान बेरिलियम से रेडियम तक घटते हैं तथा आयनिक यौगिक बनाने की प्रवृत्ति में वृद्धि व्यक्त करते हैं। बेरिलियम का उच्च विद्युत ऋणात्मकता मान (1.5) प्रदर्शित करता है कि यह धातु आयनिक यौगिक बनाती है।
रासायनिक गुण (Chemical Properties)
क्षारीय मृदा धातुएँ क्षार धातुओं से कम क्रियाशील होती हैं। इन तत्वों की अभिक्रियाशीलता वर्ग में ऊपरे: से नीचे जाने पर बढ़ती है।
1. वायु एवं जल के प्रति अभिक्रियाशीलता (Reactivity with air and water)–बेरिलियम एवं मैग्नीशियम गतिकीय रूप से ऑक्सीजन तथा जल के प्रति निष्क्रिय हैं; क्योंकि इन धातुओं के पृष्ठों (surfaces) पर ऑक्साइड की फिल्म जम जाती है। फिर भी, बेरिलियम चूर्ण रूप में वायु में जलने पर BeO एवं Be2N3 बना लेता है। मैग्नीशियम अधिक धनविद्युतीय है, जो वायु में अत्यधिक चमकीले प्रकाश के साथ जलते हुए MgO तथा Mg3N2 बना लेता है। कैल्सियम, स्ट्रॉन्शियम एवं बेरियम वायु से शीघ्र अभिक्रिया करके ऑक्साइड तथा नाइट्राइड बनाते हैं। ये जल से और भी अधिक तीव्रता से अभिक्रिया करते हैं; यहाँ तक कि ठण्डे जल से अभिक्रिया कर हाइड्रॉक्साइड बनाते हैं।
2. हैलोजेन के प्रति अभिक्रियाशीलता (Reactivity with halogens)-सभी क्षारीय मृदा धातुएँ हैलोजेन के साथ उच्च ताप पर अभिक्रिया करके हैलाइड बना लेती हैं-
M+X2 → MX2 (X= F, CI, Br, I)
BeF2 बनाने की सबसे सरल विधि (NH4)2BeF4 का तापीय अपघटन है, जबकि BeCl2, ऑक्साइड से सरलतापूर्वक बनाया जा सकता है

इन धातुओं के ऑक्साइडों, हाइड्रॉक्साइडों तथा कार्बोनेटों पर हैलोजेन अम्लों (HX) की प्रतिक्रिया द्वारा भी हैलाइड बनाए जा सकते हैं।
M+2HX → MX2 +H2
MO+2HX→ MX2 +H2O
M(OH)2 + 2HX → MX2 + 2H2O
MCO3 +2HX → MX2 +H2O+CO2
3. हाइड्रोजन के प्रति अभिक्रियाशीलता (Reactivity with dihydrogen)-बेरिलियम के अतिरिक्त सभी क्षारीय मृदा धातुएँ गर्म करने पर डाइहाइड्रोजन से अभिक्रिया करके हाइड्राइड बनाती हैं।
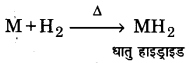
BeH2 को BeCl2 एवं LiAlH4 की अभिक्रिया से बनाया जा सकता है
2BeCl2 +LiAlH4 → 2BeH2 +LiCl + AlCl3
BeH2 तथा MgH2 प्रवृत्ति में सहसंयोजी होते हैं, जबकि अन्य धातुओं के हाइड्राइडों की आयनिक संरचना होती है। आयनिक हाइड्राइड; जैसे—CaH2 (यह हाइड्रोलिथ भी कहलाता है।) जल से क्रिया करके डाइहाइड्रोजन गैस मुक्त करता है।

4. अम्लों के प्रति अभिक्रियाशीलता (Reactivity with acids)-क्षारीय मृदा धातुएँ शीघ्र ही अम्लों . से अभिक्रिया कर डाइहाइड्रोजन गैस मुक्त करती हैं।
M+2HCI→ MCl2 +H2 ↑
5. अपचायक प्रकृति (Reducing nature)—प्रथम वर्ग की धातुओं के समान क्षारीय मृदा धातुएँ प्रबल अपचायक हैं। इसका बोध इनके अधिक ऋणात्मक अपचयन विभव के मानों से होता है। यद्यपि इनकी अपचयन-क्षमता क्षार धातुओं की तुलना में कम होती है। बेरिलियम के अपचयन विभव का मान अन्य क्षारीय मृदा धातुओं से कम ऋणात्मक होता है फिर भी इसकी अपचयन-क्षमता का कारण Be2+ आयन के छोटे आकार, इसकी उच्च जलयोजन ऊर्जा एवं धातु की उच्चं परमाण्वीयकरण एन्थैल्पी का होना है।
6. द्रव अमोनिया में विलयन (Solution in liquid ammonia)-क्षार धातुओं की भाँति क्षारीय मृदा धातुएँ भी द्रव अमोनिया में विलेय होकर गहरे नीले-काले रंग का विलयन बना लेती हैं। इस विलयन से धातुओं के अमोनीकृत आयन प्राप्त होते हैं-
M+(x + y)NH3 → [M(NH3)x]2+ + 2[e(NH3)y]–
इन विलयनों से पुन: अमोनिएट्स (ammoniates) [M(NH3)6]2+ प्राप्त किए जा सकते हैं।
7. कार्बोनेटों का बनना (Formation of carbonates)-धातु के हाइड्रॉक्साइडों के जलीय विलयनों में CO2 की वाष्प की सीमित मात्रा प्रवाहित करने पर धातुओं के कार्बोनेट सफेद अवक्षेप के रूप में प्राप्त किए जा सकते हैं।

प्रश्न 3.
क्षार धातुएँ प्रकृति में क्यों नहीं पाई जाती हैं?
उत्तर
बहुत अधिक अभिक्रियाशीलता के कारण क्षार धातुएँ प्रकृति में मुक्त अवस्था में नहीं पायी जाती हैं। जाती हैं।
प्रश्न 4.
Na2O3 में सोडियम की ऑक्सीकरण अवस्था ज्ञात कीजिए।
उत्तर
माना Na2O2 में सोडियम की ऑक्सीकरण अवस्था x है। Na2O2 एक परॉक्साइड है और इसमें एक परॉक्सी ——O बन्ध है। इसमें ऑक्सीजन की ऑक्सीकरण अवस्था -1 है।
इस प्रकार, Na2O2 के लिये
(2xx)+(-1×2)= 0
x = +1
प्रश्न 5.
पोटैशियम की तुलना में सोडियम कम अभिक्रियाशील क्यों है? बताइए।
उत्तर
सोडियम का मानक झ्लेक्ट्रोड विभव (E⊖ = -2.714 V) पोटैशियम के मानक इलेक्ट्रोड विभ्रव (-2.925 V) की तुलना में अधिक है। इसके अतिरिक्त, सोडियम की आयनन एन्थैल्पी (496kJ mol-1) भी पोटैशियम की आयनन एन्थैल्पी (419kJ mol-1 से अधिक है। अत: सोडियम पोटैशियम से कम अभिक्रियाशील है।
प्रश्न 6.
निम्नलिखित के सन्दर्भ में क्षार धातुओं एवं क्षारीय मृदा धातुओं की तुलना कीजिए-
(क) आयनन एन्थैल्पी,
(ख) ऑक्साइडों की क्षारकता,
(ग) हाइड्रॉक्साइडों की विलेयता।
उत्तर
- क्षारीय मृदा धातुओं की आयनन एन्थैल्पी क्षार धातुओं की तुलना में अधिक होती है, क्योंकि क्षारीय मृदा धातुओं में नाभिकीय आवेश अधिक होता है।
- क्षार धातु ऑक्साइड क्षारीय मृदा धातु ऑक्साइडों की तुलना में अधिक क्षारीय होते हैं, क्योंकि क्षार धातुएँ क्षारीय मृदा धातुओं की तुलना में अधिक विद्युत धनात्मक होती हैं।
- क्षार धातु हाइड्रॉक्साइड क्षारीय मृदा धातु हाइड्रॉक्साइडों की तुलना में जल में अधिक घुलनशील होते हैं, क्योंकि क्षारीय मृदा धातुओं की जालक एन्थैल्पी क्षार धातुओं की तुलना में अधिक होती है।
प्रश्न 7.
लीथियम किस प्रकार मैग्नीशियम से रासायनिक गुणों में समानताएँ दर्शाता है?
उत्तर
लीथियम एवं मैग्नीशियम के रासायनिक गुणों में समानताएँ (Similarities between Chemical Properties of Lithium and Magnesium)
लीथियम एवं मैग्नीशियम के रासायनिक गुणों में समानता के प्रमुख बिन्दु निम्नवत् हैं-
- लीथियम एवं मैग्नीशियम जल के साथ धीमी गति से अभिक्रिया करते हैं। इनके ऑक्साइड एवं हाइड्रॉक्साइड बहुत.कम घुलनशील हैं। हाइड्रॉक्साइड गर्म करने पर विघटित हो जाते हैं। दोनों ही नाइट्रोजन से सीधे संयोग करके नाइट्राइडे क्रमश: Li3N एवं Mg3N2 बनाते हैं।
- Li2O एवं MgO ऑक्सीजन के आधिक्य से अभिक्रिया करके सुपर ऑक्साइड नहीं बनाते हैं।
- लीथियम एवं मैग्नीशियम धातुओं के कार्बोनेट गर्म करने पर सरलतापूर्वक विघटित होकर उनके ऑक्साइड एवं CO2 बनाते हैं। दोनों ही ठोस हाइड्रोजन कार्बोनेट नहीं बनाते हैं।
- LiCl एवं MgCl2 एथेनॉल में विलेय हैं।
- LiCl एवं MgCl2 दोनों ही प्रस्वेद्य (deliquescent) यौगिक हैं। ये जलीय विलयन से | LiCl.2H2O एवं MgCl2.8H2O के रूप में क्रिस्टलीकृत होते हैं।
प्रश्न 8.
क्षार धातुएँ तथा क्षारीय मृदा धातुएँ रासायनिक अपचयन विधि से क्यों नहीं प्राप्त किए जा सकते हैं? समझाइए।
उत्तर
क्षार धातुएँ तथा क्षारीय मृदा धातुएँ सामान्य उपयोग में आने वाले अपचायकों से अधिक प्रबल अपचायक हैं। इसलिए ये रासायनिक अपचयन विधियों द्वारा प्राप्त नहीं की जा सकती हैं।
प्रश्न 9.
प्रकाश विद्युत सेल में लीथियम के स्थान पर पोटैशियम एवं सीजियम क्यों प्रयुक्त किए जाते हैं?
उत्तर
लीथियम की आयनन एन्थैल्पी (ionisation enthalpy) (520 kJmol-1), पोटैशियम (419kJ mol-1) और सीजियम (376 kJ mo-1) की आयनन एन्थैल्पी से बहुत अधिक है। इस कारण यह प्रकाश की क्रिया से इलेक्ट्रॉन का उत्सर्जन नहीं करता जबकि पोटैशियम और सीजियम ऐसा करने में समर्थ हैं। इसलिए प्रकाश वैद्युत सेल में लीथियम के स्थान पर पोटैशियम तथा सीजियम को प्रयुक्त किया जाता है।
प्रश्न 10.
जब एक क्षार धातु को द्रव अमोनिया में घोला जाता है, तब विलयन विभिन्न रंग प्राप्त कर सकता है। इस प्रकार के रंग-परिवर्तन का कारण बताइए।
उत्तर
जब एक क्षार धातु को द्रव अमोनिया में घोला जाता है तो अमोनीकृत धनायन (ammoniated cations) और अमोनीकृत इलेक्ट्रॉन् (ammoniated electrons) बनते हैं।
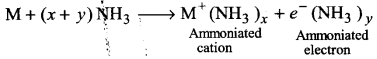
अमोनीकृत इलेक्ट्रॉन दृश्य प्रकाश (visible light) से ऊर्जा अवशोषित कर उत्तेजित हो जाते हैं और विलयन में गहरी नीला रंग उत्पन्न करते हैं। सान्द्र विलयन में, नीला रंगे काँस्य रंग में बदल जाता है।
प्रश्न 11.
ज्वाला को बेरिलियम एवं मैग्नीशियम कोई रंग नहीं प्रदान करते हैं, जबकि अन्य क्षारीय मृदा धातुएँ ऐसा करती हैं। क्यों?
उत्तर
Be और Mg की आयनन एन्थैल्पी (ionisation enthalpies) अधिक होने के कारण इनके संयोजक इलेक्ट्रॉन (valence electrons) बहुत मजबूती से बंधे होते हैं। ये बुन्सन ज्वाला (bunsen flame) की ऊर्जा द्वारा उत्तेजित नहीं होते हैं। इसलिए ये तत्त्व ज्वाला में कोई रंग नहीं देते हैं। अन्य क्षारीय मृदा धातुओं की आयनन एन्थैल्पी कम होती है और इनके संयोजक इलेक्ट्रॉन ज्वाला (flame) द्वारा उत्तेजित होकर उच्च ऊर्जा स्तर में चले जाते हैं। इस कारण ये धातुएँ ज्वाला को विशेष रंग प्रदान करती हैं।
प्रश्न 12.
सॉल्वे प्रक्रम में होने वाली विभिन्न अभिक्रियाओं की विवेचना कीजिए।
उत्तर
सॉल्वे प्रक्रम (Solvay Process)—साधारणतया सोडियम कार्बोनेट ‘सॉल्वे विधि द्वारा बनाया जाता है। इस प्रक्रिया में लाभ यह है कि सोडियम हाइड्रोजन कार्बोनेट जो अमोनियम हाइड्रोजन कार्बोनेट एवं सोडियम क्लोराइड के संयोग से अवक्षेपित होता है, अल्प विलेय होता है। अमोनियम हाइड्रोजन कार्बोनेट C0, गैस को सोडियम क्लोराइड के अमोनिया से संतृप्त सान्द्र विलयन में प्रवाहित कर बनाया जाता है। वहाँ पहले अमोनियम कार्बोनेट और फिर अमोनियम हाइड्रोजन कार्बोनेट बनती है। सम्पूर्ण प्रक्रम की अभिक्रियाएँ निम्नलिखित हैं-
2NH3 +H2O + CO2 → (NH4)2CO3

प्रकार सोडियम बाइकार्बोनेट के क्रिस्टल पृथक् हो जाते हैं जिन्हें गर्म करके सोडियम कार्बोनेट प्राप्त किया जाता है-
2NaHCO3 → Na2CO3 +CO2 ↑ +H2O
इस प्रक्रम में NH4Cl युक्त विलयन की Ca(OH)2 से अभिक्रिया पर NHS को पुनः प्राप्त किया जा सकता है। कैल्सियम क्लोराइड सह-उत्पाद के रूप में प्राप्त होता है
2NH4Cl+Ca(OH)2 → 2NH3 ↑ +CaCl2 +2H2O
प्रश्न 13.
पोटैशियम कार्बोनेट सॉल्वे विधि द्वारा नहीं बनाया जा सकता है। क्यों?
उत्तर
पोटैशियम हाइड्रोजन कार्बोनेट (KHCO3) कार्बन डाइऑक्साइड की उपस्थिति में जल में पर्याप्त मात्रा में घुलनशील है और अवक्षेपित नहीं होता है। इसलिए, K2CO3 को सॉल्वे विधि द्वारा नहीं बनाया जा सकता।
प्रश्न 14.
Li2CO3 कम ताप पर एवं Na2CO3 उच्च ताप पर क्यों विघटित होता है?
उत्तर
Li2CO3 कम ताप पर एवं Na2CO3 उच्च ताप पर विघटित होता है। Li2CO3 ऊष्मा के प्रति Na2CO3 से कम स्थायी है क्योंकि Li+ आयन आकार में बहुत छोटा है और यह बड़े ऋणायन को ध्रुवित कर अधिक स्थायी Li2O और CO2 का निर्माण करता है। यही कारण है कि Li2CO3 कम ताप पर विघटित हो जाता है। Na+ आयन आकार में बड़ा होता है और CO2-3 को ध्रुवित करने में असमर्थ है। इसलिएं Na2CO3 उच्च ताप पर स्थिर है।
प्रश्न 15.
क्षार धातुओं के निम्नलिखित यौगिकों की तुलना क्षारीय मृदा धातुओं के संगत यौगिकों से विलेयता एवं तापीय स्थायित्व के आधार पर कीजिए—
(क) नाइट्रेट
(ख) कार्बोनेट
(ग) सल्फेट।
उत्तर
विलेयता–सभी क्षार धातुओं के नाइट्रेट, कार्बोनेट, सल्फेट जल में घुलनशील हैं और इनकी विलेयता समूह में ऊपर से नीचे जाने पर बढ़ती है, क्योंकि जलयोजन ऊर्जा (hydration energy) की तुलना में जालक ऊर्जा तेजी से घटती है।
सभी क्षारीय मृदा धातुओं के नाइट्रेट भी जल में घुलनशील हैं, परन्तु इनकी विलेयता समूह में नीचे चलने पर घटती जाती है क्योकि जलयोजन, ऊर्जा (hydration energy) जालक ऊर्जा (lattice energy) की अपेक्षा तेजी से घटती है। क्षारीय मृदा धातु कार्बोनेट जल में अधिक घुलनशील नहीं हैं और इनकी विलेयता समूह में ऊपर से नीचे जाने पर घटती है। BeCO3 जल में सूक्ष्म विलेय है और CaCO3 लगभग अविलेय। समूह में ऊपर से नीचे जाने पर विलेयता घटती है क्योंकि जलयोजन ऊर्जा घटती है। क्षारीय मृदा धातु सल्फेट क्षार धातु सल्फेट से जल में कम विलेय है। इनकी विलेयता समूह में ऊपर से नीचे चलने पर घटती है।
क्षारीय मृदा धातु सल्फेटों की जालक ऊर्जा क्षार धातु सल्फेटों की जालक ऊर्जा से अधिक होती है। यही कारण है कि इनकी विलेयता क्षार धातु सल्फेटों से कम होती है। समूह, में ऊपर से नीचे जाने पर जलयोजन ऊर्जा का मान घटता है परन्तु जालक ऊर्जा में कोई परिवर्तन नहीं होता। इसलिए BeSO4 से BaSO4 तक जाने पर विलेयता घटती है।
तापीय स्थायित्व
(क) क्षारीय मृदा धातुओं और क्षार धातुओं के नाइट्रेट गर्म करने पर विघटित हो जाते हैं। क्षार धातु के नाइट्रेट (Li के अतिरिक्त) विघटित होकर धातु नाइट्राइट बनाते हैं।

सभी क्षारीय मृदा धातु नाइट्रेट विघटित होकर धातु ऑक्साइड, NO2 तथा O2 देते हैं।

(ख) क्षार धातु के कार्बोनेट (Li के अतिरिक्त) उच्च ताप पर भी विघटित नहीं होते हैं। लीथियम कार्बोनेट विघटित होकर लीथियम ऑक्साइड और कार्बन डाइऑक्साइड देता है।

क्षारीय मृदा धातुओं के कार्बोनेट गर्म करने पर विघटित होकर धातु ऑक्साइड और CO2 बनाते हैं।

क्षारीय मृदा धातु कार्बोनेटों के विघटन का ताप समूह में ऊपर से नीचे चलने पर बढ़ता है। इस कारण इनके स्थायित्व में वृद्धि होती है जो समूह में ऊपर से नीचे जाने पर विद्युत धनात्मक गुणों (electropositive character) में वृद्धि के कारण है।
(ग) क्षार धातुओं के सल्फेट (Li के अतिरिक्त) बहुत अधिक स्थायी होते हैं और आसानी से विघटित नहीं होते। लीथियम सल्फेट निम्न प्रकार विघटित होता है-

क्षारीय मृदा धातुओं के सल्फेटों में भी ऊष्मीय स्थायित्व (thermal stability) होता है और गर्म करने पर आसानी से विघटित नहीं होते हैं। यह इनकी उच्च जालक ऊर्जा के कारण होता है। फिर भी, ये अति उच्च ताप पर विघटित हो सकते हैं।
प्रश्न 16.
सोडियम क्लोराइड से प्रारम्भ करके निम्नलिखित को आप किस प्रकार बनाएँगे?
(i) सोडियम धातु
(ii) सोडियम हाइड्रॉक्साइड,
(iii) सोडियम परॉक्साइड,
(iv) सोडियम कार्बोनेट।
उत्तर
(i) सोडियम धातु NaCl (40%) और CaCl2(60%) के मिश्रण का विद्युत अपघटन करने पर प्राप्त होती है। इसमें लोहा (iron) कैथोड और ग्रेफाइट ऐनोड (Down’s cell) का प्रयोग किया जाता है। CaCl2 का उपयोग NaCl का गलनांक कर्म करने के लिए किया जाता है। विद्युत अपघटन करने पर। Na कैथोड (cathode) पर प्राप्त होता है।

(ii) सोडियम क्लोराइड के जलीय विलयन का नेलसन सेल अथवा कास्टनर-कैलनर सेल में विद्युत अपघटन करने पर सोडियम हाइड्रॉक्साइड (sodium hydroxide) बनता है। इसमें पारा (mercury) कैथोड तथा कार्बन (carbon) ऐनोड का प्रयोग किया जाता है।
नेलसन सेल में-
NaCl → Na+ + Cl–
H2O ⇌ H+ + OH–
Na+ + OH– ⇌ NaOH
कास्टनर-कैलनर सेल में-
NaCl→ Na+ + Cl–
H2O ⇌ H+ + OH–
Na+ + e– → Na
Na + Hg → Na/Hg
NaOH→ Na+ +OH–
H2O ⇌ H+ + OH–
OH– → OH+ e–
Na/Hg → NaOH+e–
(iii) सोडियम को CO2 मुक्त वायु की अधिकता में गर्म करने पर सोडियम परॉक्साइड बनता है।
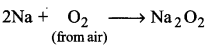
(iv) CO2 अमोनिया युक्त नमक के घोल में प्रवाहित करने पर सोडियम बाइकार्बोनेट (NaHCO3) का अवक्षेप प्राप्त होता है जो गर्म करने पर सोडियम कार्बोनेट (Na2CO3) देता है (Solvay ammonia soda process)।
NaCl + NH3 + CO2 + H2O → NaHCO3 ↓+ NH4Cl
2NaHCO3 → Na2CO4 + CO2 +H2O
प्रश्न 17.
क्या होता है जब?
(i) मैग्नीशियम को हवा में जलाया जाता है।
(ii) बिना बुझे चूने को सिलिका के साथ गर्म किया जाता है।
(iii) क्लोरीन बुझे चूने से अभिक्रिया करती है।
(iv) कैल्सियम नाइट्रेट को गर्म किया जाता है।
उत्तर

प्रश्न 18.
निम्नलिखित में से प्रत्येक के दो-दो उपयोग लिखिए
(i) कॉस्टिक सोडा
(ii) सोडियम कार्बोनेट
(iii) बिना बुझा चूना।।
उत्तर
(i) कॉस्टिक सोडा के उपयोग (Uses of caustic soda)-
- साबुन, कागज, कृत्रिम रेशम तथा कई अन्य रसायनों के निर्माण में।
- पेट्रोलियम के परिष्करण में।।
(ii) सोडियम कार्बोनेट के उपयोग (Uses of sodium carbonate)-
- जल के मृदुकरण, धुलाई एवं निर्मलन में।
- काँच, साबुन, बोरेक्स एवं कॉस्टिक सोडा के निर्माण में।
(iii) बिना बुझा चूना के उपयोग (Uses of quick lime)-
- सीमेण्ट के निर्माण के लिए प्राथमिक पदार्थ के रूप में तथा क्षारक के सबसे सस्ते रूप में।
- शर्करा के शुद्धिकरण में एवं रंजकों (dye stuffs) के निर्माण में।
प्रश्न 19.
निम्नलिखित की संरचना बताइए
(i) BeCl2 (वाष्प),
(ii) BeCl2 (ठोस)।
उत्तर
BeCl2 की संरचना (Structure of BeCl2)
(i) वाष्प अवस्था में (In vapour state)-वाष्प अवस्था में यह यौगिक द्विलक (dimer) के रू में पाया जाता है। (Be परमाणु sp-संकरित होता है) जो लगभग 1000K ताप पर अपघटित होकर एक एकलक (monomer) देता है जिसमें Be परमाणु sp-संकरण अवस्था में होता है।

(ii) ठोस अवस्था में (In solid state)–ठोस अवस्था में बेरिलियम क्लोराइड की श्रृंखला संरचना (बहुलक) होती है जिसमें समीपवर्ती अणुओं पर उपस्थित क्लोरीन परमाणुओं से इलेक्ट्रॉन-युग्म इलेक्ट्रॉन न्यून Be परमाणु को दान करके उपसहसंयोजी बन्ध निम्नवत् बनता है

बहुलक उपर्युक्त श्रृंखला संरचना में Be परमाणु sp3 -संकरित होता है, परन्तु Cl—Be—Cl बन्ध कोण सामान्य चतुष्फलकीय बन्ध कोण (109:5°) से अत्यधिक कम (98°) होता है।
प्रश्न 20.
सोडियम एवं पोटैशियम के हाइड्रॉक्साइड एवं कार्बोनेट जल में विलेय हैं, जबकि मैग्नीशियम एवं कैल्सियम के संगत लवण जल में अल्प विलेय हैं, समझाइए।
उत्तर
सोडियम एवं पोटैशियम आयनों का आकार मैग्नीशियम एवं कैल्सियम आयनों की अपेक्षा बड़ा होता है। बड़े आकार के कारण, सोडियम तथा पोटैशियम के हाइड्रॉक्साइडों एवं कार्बोनेटों की जालक ऊर्जाओं का मान मैग्नीशियम एवं कैल्सियम के हाइड्रॉक्साइडों एवं कार्बोनेटों की जालक ऊर्जाओं (lattice energies) के मान से बहुत कम है। यही कारण है कि सोडियम तथा पोटैशियम के हाइड्रॉक्साइड एवं कार्बोनेट जल में आसानी से विलेय हो जाते हैं, जबकि मैग्नीशियम एवं कैल्सियम के हाइड्रॉक्साइड एवं कार्बोनेट जल में अल्प विलेय हैं।
प्रश्न 21.
निम्नलिखित की महत्ता बताइए
(i) चूना पत्थर,
(ii) सीमेण्ट,
(iii) प्लास्टर ऑफ पेरिस।
उत्तर
(i) चूना पत्थर की महत्ता (Importance of Lime stone)
- संगमरमर के रूप में भवन निर्माण में।
- बुझे चूने के निर्माण में।
- कैल्सियम कार्बोनेट को मैग्नीशियम कार्बोनेट के साथ लोहे जैसी धातुओं के निष्कर्षण में फ्लक्स (flux) के रूप में।
- विशेष रूप से अवक्षेपित CaCO3 के प्रयोग से वृहद् रूप में उच्च गुणवत्ता वाले कागज के निर्माण में।
- ऐन्टासिड, टूथपेस्ट में अपघर्षक के रूप में, च्यूइंगम के संघटक एवं सौन्दर्य प्रसाधनों में पूरक के रूप में।
(ii) सीमेण्ट की महत्ता (Importance of Cement)
लोहा तथा स्टील के पश्चात् सीमेण्ट ही एक ऐसा पदार्थ है जो किसी राष्ट्र की उपयोगी वस्तुओं की श्रेणी में रखा जा सकता है। इसका उपयोग कंक्रीट, प्रबलित कंक्रीट, प्लास्टरिंग, पुल निर्माण आदि में किया जाता है।
(iii) प्लास्टर ऑफ पेरिस की महत्ता (Importance of Plaster of Paris)
प्लास्टर ऑफ पेरिस का वृहत्तर उपयोग भवन निर्माण उद्योग के साथ-साथ टूटी हुई हड्डियों के प्लास्टर में भी होता है। इसका उपयोग दन्त-चिकित्सा, अलंकरण-कार्य एवं मूर्तियों तथा अर्द्ध-प्रतिमाओं को बनाने में भी होता है।
प्रश्न 22.
लीथियम के लवण साधारणतया जलयोजित होते हैं, जबकि अन्य क्षार धातुओं के लवण साधारणतया निर्जलीय होते हैं। क्यों?
उत्तर
सभी क्षार धातु आयनों में Li+ आयन आकार में सबसे छोटा है। अपने छोटे आकार के कारण यह जल अणु (water molecule) को ध्रुवित कर देता है, उससे जुड़ जाता है और अन्य क्षार धातुओं की अपेक्षा आसानी से जलयोजित हो जाता है। इस कारण लीथियम के लवण सामान्यत: जलयोजित होते हैं, जैसे-LiCl.2H2O
प्रश्न 23.
LiF जल में लगभग अविलेय होता है, जबकि LiCl न सिर्फ जल में, बल्कि ऐसीटोन में भी विलेय होता है। कारण बताइए।
उत्तर
LiF की जालक ऊर्जा (-1005 kJ mol-1) LiCl की जालक ऊर्जा (- 845 kJ mol-1) से अधिक है जिस कारण LiF जल में लगभग अविलेय तथा LiCl जल में विलेय है। इसके अतिरिक्त Cl आयन के F आयन की अपेक्षा आकार में बड़ा होने के कारण LiCl की ध्रुवीकरण की मात्रा LiF की अपेक्षा अधिक होती है। उच्च ध्रुवीकरण की मात्रा के कारण LiCl में सहसंयोजक गुण अधिक होता है। और यह ऐसीटोन organic solvent) में विलेय है।
प्रश्न 24.
जैव द्रवों में सोडियम, पोटैशियम, मैग्नीशियम एवं कैल्सियम की सार्थकता बताइए।
उत्तर
सोडियम एवं पोटैशियम की जैव द्रवों में सार्थकता (Significance of Sodium and Potassium in Biological Fluids) 70 किग्रा भार वाले एक सामान्य व्यक्ति में लगभग 90 ग्राम सोडियम एवं 170 ग्राम पोटैशियम होता है, जबकि लोहा केवल 5 ग्राम तथा ताँबा 0:06 ग्राम होता है।
सोडियम आयन मुख्यतः अन्तराकाशीय द्रव में उपस्थित रक्त प्लाज्मा, जो कोशिकाओं को घेरे रहता है, में पाया जाता है। ये आयन शिरा-संकेतों के संचरण में भाग लेते हैं, जो कोशिका झिल्ली में जलप्रवाह को नियमित करते हैं तथा कोशिकाओं में शर्करा और ऐमीनो अम्लों के प्रवाह को भी नियन्त्रित करते हैं। सोडियम एवं पोटैशियम रासायनिक रूप से समान होते हुए भी कोशिका झिल्ली को पार करने की क्षमता एवं एन्जाइम को सक्रिय करने में मात्रात्मक रूप से भिन्न हैं। इसीलिए कोशिकाद्रव्य में पोटैशियम धनायन बहुतायत में होते हैं, जहाँ ये एन्जाइम को सक्रिय करते हैं तथा ग्लूकोस के ऑक्सीकरण से ATP बनने में भाग लेते हैं। सोडियम आयन शिरा-संकेतों के संचरण के लिए। उत्तरदायी हैं।
कोशिका झिल्ली के अन्य भागों में पाए जाने वाले सोडियम एवं पोटैशियम आयनों की सान्द्रता में अत्यधिक भिन्नता पाई जाती है। उदाहरण के लिए-रक्त प्लाज्मा में लाल रक्त कणिकाओं में सोडियम की मात्रा 143 m mol L-1 है, जबकि पोटैशियम का स्तर केवल 5 m mol L-1 है। यह सन्द्रिता 10 m mol L-1 (Na+) एवं 105 m mol L-1 (K) तक परिवर्तित हो सकती है। यह असाधारण आयनिक उतार-चढ़ाव, जिसे सोडियम-पोटैशियम पम्प कहते हैं, कोशिका झिल्ली पर कार्य करता है, जो मनुष्य की विश्रामावस्था के कुल उपभोगित ATP की एक-तिहाई से ज्यादा का उपयोग कर लेता है, जो मात्रा लगभग 15 किलो जूल प्रति 24 घण्टे तक हो सकती है।
मैग्नीशियम एवं कैल्सियम की जैव द्रवों में सार्थकता (Significance of Magnesium and Calcium in Biological Fluids)
एक वयस्क व्यक्ति में लगभग 25 ग्राम मैग्नीशियम एवं 1200 ग्राम कैल्सियम होता है, जबकि लोहा मात्र 5 ग्राम एवं ताँबा 0-06 ग्राम होता है। मानव-शरीर में इनकी दैनिक आवश्यकता 200-300 मिग्री अनुमानित की गई है।
समस्त एन्जाइम, जो फॉस्फेट के संचरण में ATP का उपयोग करते हैं, मैग्नीशियम का उपयोग सह-घटक के रूप में करते हैं। पौधों में प्रकाश-अवशोषण के लिए मुख्य रंजक (pigment) क्लोरोफिल में भी मैग्नीशियम होता है। शरीर में कैल्सियम का 99% दाँतों तथा हड्डियों में होता है। यह अन्तरतांत्रिकीय पेशीय कार्यप्रणाली, अन्तरतांत्रिकीय प्रेषण, कोशिका झिल्ली अखण्डता (cell membrane integrity) तथा रक्त-स्कन्दन (blood-coagulation) में भी महत्त्वपूर्ण भूमिका निभाता है। प्लाज्मा में कैल्सियम की सान्द्रता लगभग 100 mg L-1 होती है। दो हॉर्मोन कैल्सिटोनिन एवं पैराथायरॉइड इसे बनाए रखते हैं। चूँकि हड्डी अक्रिय तथा अपरिवर्तनशील पदार्थ नहीं है, यह किसी मनुष्य में लगभग 400 मिग्रा प्रतिदिन के अनुसार विलेयत और निक्षेपित होती है। इसका सारा कैल्सियम प्लाज्मा में से ही गुजरता है।
प्रश्न 25.
क्या होता है जब?
(i) सोडियम धातु को जल में डाला जाता है।
(ii) सोडियम धातु को हवा की अधिकता में गर्म किया जाता है।
(iii) सोडियम परॉक्साइड को जल में घोला जाता है।
उत्तर
(i) 2Na (s) +2H2O(l) → 2NaOH(aq) + H2 (g)
H2 गैस मुक्त होती है जो अभिक्रिया में उत्पन्न ऊर्जा के कारण आग पकड़ लेती है।
(ii) 
(iii) Na2O2(s) + 2H2O (l) → 2NaOH(aq) + H2O2(aq)
प्रश्न 26.
निम्नलिखित में से प्रत्येक प्रेक्षण पर टिप्पणी लिखिए-
(क) जलीय विलयनों में क्षार धातु आयनों की गतिशीलता Li+ <Na+ <K+ <Rb+ <Cs+ क्रम में होती है।
(ख) लीथियम ऐसी एकमात्र क्षार धातु है, जो नाइट्राइड बनाती है।
(ग) M2+ (aq) + 2e– → M(s) हेतु E⊖ (जहाँ M = Ca, Sr या Ba) लगभग स्थिरांक है।
उत्तर
(क) क्षार धातु आयन का आकार जितना छोटा होगा, उसकी जलयोजन की मात्रा उतनी अधिक होगी और उसकी गतिशीलता भी उतनी ही कम होगी। क्षार धातु आयनों के आकार का क्रम निम्न हैLi’ <Na’ <K’ < Rb <Cs’ इसलिए क्षार धातु आयनों की गतिशीलता का क्रम Li+ < Na+ K+ < Rb+ < Cs+
(ख) लीथियम और मैग्नीशियम विकर्ण सम्बन्ध रखते हैं। ये दोनों लगभग समान विद्युत ऋणात्मक हैं। इसलिए Mg की तरह लीथियम भी नाइट्रोजन से अभिक्रिया करके नाइट्राईड बन्मता है जबकि दूसरे । क्षार धातु ऐसा करने में असमर्थ हैं।

(ग) किसी भी निकाय के लिए E⊖ मान निम्नलिखित तीन कारकों पर निर्भर करता है
- वाष्पन की ऊष्मा
- आयनन की ऊष्मा
- जलीकरण की ऊष्मा
उपर्युक्त तीनों कारकों का सम्मिलित प्रभाव Ca, Sr और Ba पर समान है। इसलिये इन तीनों के लिए E⊖ का मान लगभग समान होता है।
प्रश्न 27.
समझाइए कि क्यों
(क) Na2CO3 का विलयन क्षारीय होता है।
(ख) क्षार धातुएँ उनके संगलित क्लोराइडों के विद्युत-अपघटन से प्राप्त की जाती हैं।
(ग) पोटैशियम की तुलना में सोडियम अधिक उपयोगी है।
उत्तर
(क) Na2CO3 एक दुर्बल अम्ल (H2CO3) और एक प्रबल क्षार (NaOH) से बना लवण है। जब यह जल में घोला जाता है, तो निम्न प्रकार से जल अपघटित हो जाता है-
NaCO3 → 2Na+ + CO2-3
CO2-3 +2H2O →H2CO3 + 2OH–
OH– की अधिकता के कारण विलयन क्षारीय होता है।
(ख) क्षार धातु आयनों के मानक अपचयन विभव का मान हाइड्रोजन के मानक अपचयन विभव के मान से बहुत कम होता है। इसलिए, क्षार धातु क्लोराइड के जलीय विलयन का विद्युत अपघटन करने पर क्षार धातु के स्थान पर हाइड्रोजन कैथोड पर मुक्त होती है। क्षार धातुओं का निर्माण उनके संगलित क्लोराइडों के विद्युत अपघटन से किया जाता है।
(ग) सोडियम जैविक क्रियाविधि में पोटैशियम (K) की अपेक्षा अधिक उपयोगी है। सोडियम आयन तन्त्रिका (nerve) आवेग के संचरण में, कोशिका झिल्ली (cell membrane) में जल के परिवहन में और शुगर वे अमीनो अम्लों के कोशों में परिवहन में सहायता करता है। सोडियम कोशों को घेरे हुए blood plasma में रहता है। यद्यपि K+ आयन भी जैविक तन्त्रों में उपयोगी कार्य करते हैं फिर भी Na+ का कार्य अधिक महत्त्वपूर्ण है। यही कारण है कि सोडियम, पोटैशियम से अधिक आवश्यक है।
प्रश्न 28.
निम्नलिखित के मध्य क्रियाओं के सन्तुलित समीकरण लिखिए
(क) Na2CO3 एवं जल
(ख) KO2 एवं जल
(ग) Na2O एवं CO2.
उत्तर
(क) Na2O2 (s) + 2H2O(l) → 2NaOH(aq) + H2O2 (aq)
(ख) 2KO2 (s)+ 2H2O(l) → 2KOH(aq) + H2O2 (aq) + O2 (g)
(ग) Na2O(s) + CO2(g) → Na2CO3 (s)
प्रश्न 29.
आप निम्नलिखित तथ्यों को कैसे समझाएँगे
(क) Be0 जल में अविलेय है, जबकि BeSO4 विलेय है।
(ख) BaO जल में विलेय है, जबकि BaSO4 अविलेय है।
(ग) एथेनॉल में Lil, KI की तुलना में अधिक विलेय है।
उत्तर
(क) BeO सहसंयोजक प्रकृति का होता है और जल में अविलेय है, जबकि BeSO4 आयनिक प्रकृति का होता है और जल में विलेय है। BeSO4 की जलयोजन ऊर्जा Be2+ आयन का आकार छोटा होने के कारण जालक ऊर्जा से बहुत अधिक होती है। इस कारण यह जल में विलेय है।
(ख) BaO और BaSO4 दोनों आयनिक प्रकृति के होते हैं, परन्तु SO2-4 आयन का आकार O2-2 आयन के आकार से अधिक होता है। चूंकि एक छोटा ऋणायन बड़े धनायन को जितनी स्थिरता प्रदान करता है, बड़ा ऋणायन बड़े धनायन को उससे कहीं अधिक क्षमता से स्थिर बनाता है, अत: BaSO4 की जालक ऊर्जा BaO से बहुत अधिक होती है। यही कारण है कि BaO जल में विलेय है जबकि BaSO4 अविलेय।।
(ग) Li+ आयन K+ आयन से बहुत छोटा होता है और यह I– आयन को K+ आयन की अपेक्षा अधिक सीमा तक ध्रुवित कर सकता है। इस प्रकार LiI में सहसंयोजक गुण KI से अधिक है। यही कारण है कि LiI एथिल ऐल्कोहल में KI की अपेक्षा अधिक घुलनशील है।
प्रश्न 30.
इनमें से किस क्षार धातु का गलनांक न्यूनतम है?
(क) Na
(ख) K
(ग) Rb
(घ) Cs
उत्तर
(घ) Cs धातु के परमाणु का आकार बढ़ने पर गलनांक कम हो जाता है, क्योंकि आकार बढ़ने पर धातु आबन्ध कमजोर हो जाते हैं।
प्रश्न 31.
निम्नलिखित में से कौन-सी क्षार धातु जलयोजित लवण देती है?
(क) Li
(ख) Na
(ग) K
(घ) Cs
उत्तर
(क) Li उपर्युक्त सभी क्षार धातुओं में Li+ का आकार सबसे छोटा है। इस कारण Li+
आयन H2O अणु को अधिक ध्रुवित कर देता है, उससे जुड़ जाता है और जलयोजित हो जाता है।
प्रश्न 32.
निम्नलिखित में से कौन-सी क्षारीय मृदा धातु कार्बोनेट ताप के प्रति सबसे अधिक स्थायी है?
(क) MgCO3
(ख) CaCO3
(ग) SrCO3
(घ) BaCO3
उत्तर
(घ) BaCO3 धातु का विद्युत धनात्मक गुण बढ़ने पर धातु कार्बोनेट का ताप के प्रति स्थायित्व बढ़ता है।
परीक्षोपयोगी प्रश्नोत्तर
बहुविकल्पीय प्रश्न
प्रश्न 1.
क्षार धातुएँ सम्बन्धित हैं।
(i) -ब्लॉक
(ii) p-ब्लॉक
(iii) d-ब्लॉक
(iv) f-ब्लॉक
उत्तर
(i) -ब्लॉक
प्रश्न 2.
निम्नलिखित में से किसकी हाइड्रेशन (जलयोजन) ऊर्जा अधिकतम है?
(i) Li+
(ii) Na+
(iii) K+
(iv) Rb+
उत्तर
(i) Li+
प्रश्न 3.
Mg2+ की जलयोजन क्षमता निम्न की अपेक्षा अधिक होती है।
(i) Al3+
(ii) Na+
(iii) Mg3+
(iv) Be2+
उत्तर
(ii) Na+
प्रश्न 4.
किस आयन की जल में चालकता सबसे अधिक है?
(i) Li+
(ii) Na+
(iii) K+
(iv) Cs+
उत्तर
(iv) Cs+
प्रश्न 5.
सोडियम तत्त्व को किसमें रखा जाता है?
(i) केरोसीन में
(ii) टॉलूईन में
(iii) बेन्जीन में
(iv) ऐल्कोहॉल में
उत्तर
(i) केरोसीन में
प्रश्न 6.
सोडा ऐश है ।
(i) Na2CO3 . 6H2O
(ii) Na2CO3 . 10H2O
(iii) Na2CO3
(iv) Na2CO3 . 2H2O
उत्तर
(iii) Na2CO3
प्रश्न 7.
एक सफेद पदार्थ का जलीय विलयन क्षारीय है। यह पदार्थ हो सकता है।
(i) Na2CO3
(ii) NH4Cl
(ii) NaNO3
(iv) Fe2O3
उत्तर
(i) Na2CO3
प्रश्न 8.
निम्नलिखित में से किस यौगिक का औद्योगिक उत्पादन NaCI के विद्युत-अपघटन द्वारा किया जाता है?
(i) NaHCO3
(ii) Na2CO3
(iii) NaOH
(iv) NaOCl
उत्तर
(iii) NaOH
प्रश्न 9.
सोडियम हाइड्रॉक्साइड के औद्योगिक उत्पादन में सह-उत्पाद है।
(i) क्लोरीन
(ii) ऑक्सीजन
(iii) सोडियम कार्बोनेट
(iv) सोडियम क्लोराइड
उत्तर
(i) क्लोरीन
प्रश्न 10.
जलीय NaOH के वैद्युत अपघटन पर कौन-से आयन ऐनोड पर जाएँगे?
(i) Na+
(ii) OH–
(iii) H+
(iv) O2-
उत्तर
(i) OH–
प्रश्न 11.
जिंक को कास्टिक सोडा की अधिकता वाले विलयन में मिलाने से बनता है।
(i) Zn(OH)2
(ii) ZnO
(iii) Na2ZnO2
(iv) NaZnO2
उत्तर
(iii) Na2ZnO2
प्रश्न 12.
निम्नलिखित में घनत्व उच्चतम होता है।
(i) मैग्नीशियम का
(ii) कैल्सियम का
(iii) स्ट्रॉन्शियम का
(iv) बेरियम का
उत्तर
(iii) स्ट्रॉन्शियम का
प्रश्न 13.
निम्न में कौन-सी धातु न्यूनतम आयनिक क्लोराइड बनाती है?
(i) Be
(ii) Ca
(iii) Mg
(iv) Sr
उत्तर
(i) Be
प्रश्न 14.
निम्न में सबसे कम क्षारीय है।
(i) पोटैशियम
(ii) कैल्सियम
(iii) बेरीलियम
(iv) मैग्नीशियम
उत्तर
(iii) बेरीलियम
अतिलघु उत्तरीय प्रश्न
प्रश्न 1.
समूह I के तत्त्व क्षार धातुएँ क्यों कहलाते हैं?
उत्तर
समूह I के तत्त्व जल से अभिक्रिया करके क्षारीय प्रकृति के हाइड्रॉक्साइड बनाते हैं इसलिए इन्हें सामान्यतः क्षार धातुएँ कहते हैं।
प्रश्न 2.
सोडियम तथा पोटैशियम के एक महत्त्वपूर्ण अयस्क का नाम लिखिए।
उत्तर
सोडियम के प्रमुख अयस्क रॉक साल्ट (NaCl), चीली साल्टपीटर (NaNO3) तथा क्रायोलाइट (Na3AlF6) हैं। पोटैशियम के प्रमुख अयस्क सिल्वाइट (KCl), फेलस्पार (K2O.Al2O36SiO2) तथा कार्नेलाइट (KCl· MgCl2·6H,0) हैं।
प्रश्न 3.
क्षार धातुओं की निम्न आयनन ऊर्जाएँ होती हैं। ऐसा क्यों होता है?
उत्तर
क्षार धातुओं की आयनन ऊर्जाएँ निम्न होती हैं क्योंकि इनके परमाणु में उत्कृष्ट गैस क्रोड संयोजी कोश में उपस्थित एक s-इलेक्ट्रॉन को नाभिक के आकर्षण बल से परिरक्षित करता है। अतः बाह्य कोश के 5-इलेक्ट्रॉन पर कार्यरत प्रभावी नाभिकीय आवेश कम होता है। इसलिए इस इलेक्ट्रॉन को थोड़ी ऊर्जा देकर ही निकाला जा सकता है।
प्रश्न 4.
क्षार धातुओं के घनत्व कम क्यों होते हैं?
उत्तर
क्षार धातुओं की काय केन्द्रित घनीय संरचना होती है। यह संरचना अन्य धातु संरचनाओं की तुलना में कम सघन होती है। क्षार धातुओं की परमाणु त्रिज्याएँ भी बड़ी होती हैं। इन कारणों से क्षार धातुओं के घनत्व कम होते हैं।
प्रश्न 5.
क्षार धातुओं में से किस तत्त्व का/कौन-सा तत्त्व :
(i) उच्चतम गलनांक होता है?
(ii) प्रबलतम अपचायक है?
(iii) सबसे कम विद्युत ऋणात्मक है?
उत्तर
- लीथियम का गलनांक उच्चतम (454 K) होता है।
- गैसीय अवस्था में सीजियम तथा जलीय अवस्था में लीथियम प्रबलतम अपचायक है।
- सीजियम सबसे कम विद्युत ऋणात्मक अर्थात् सबसे अधिक विद्युत धनात्मक है।
प्रश्न 6.
क्षार धातु प्रबल अपचायक क्यों हैं? समझाइए।
उत्तर
क्षार धातुओं में इलेक्ट्रॉनों को त्यागने की प्रबल प्रवृत्ति होती है इसलिए ये प्रबल अपचायकों के रूप में कार्य करती हैं।
प्रश्न 7.
निम्नलिखित पदार्थों के रासायनिक नाम तथा सूत्र लिखिए।
(i) सोडा ऐश।
(ii) बेकिंग सोडा
(iii) कास्टिक सोडा
(iv) धावन सोडा।
उत्तर
- सोडा ऐश ⇒ सोडियम कार्बोनेट, Na2CO3
- बेकिंग सोडा ⇒ सोडियम बाइकार्बोनेट, NaHCO3
- कास्टिक सोडा ⇒ सोडियम हाइड्रॉक्साइड, NaOH
- धावन सोडा ⇒ सोडियम कार्बोनेट, Na2CO3·10H2O
प्रश्न 8.
सोडियम कार्बोनेट’के मुख्य उपयोग लिखिए।
उत्तर
- काँच, कागज तथा बोरेक्स के निर्माण में।
- जल को मृदु बनाने में।
- बेकिंग सोडा, कास्टिक सोडा आदि बनाने में।
- कपड़ों को साफ करने में।
प्रश्न 9.
निम्नलिखित पर कास्टिक सोडा की अभिक्रियाएँ लिखिए
(i) Zn
(ii) P4
(iii) CO2
(iv) Cl2
उत्तर
(i) कास्टिक सोडा Zn से अभिक्रिया करके सोडियम जिंकेट बनाता है।

(ii) कास्टिक सोडा PA से अभिक्रिया करके फॉस्जीन गैस बनाता है।

(iii) कास्टिक सोडा CO2 से अभिक्रिया करके Na2CO3 बनाता है।

(iv) कास्टिक सोडा Cl2 से अभिक्रिया करके सोडियम हाइपोक्लोराइट और सोडियम क्लोराइड बनाता है।

प्रश्न 10.
गुणात्मक विश्लेषण में NaOH के दो उपयोग लिखिए।
उत्तर
1. यह फेरिक क्लोराइड को फेरिक हाइड्रॉक्साइड में अवक्षेपित कर देता है।
FeCl3 +3NaOH → Fe(OH)3 ↓ + 3NaCl
2. यह CuSO4 से क्रिया करके इसे क्यूपिक हाइड्रॉक्साइड के रूप में अवक्षेपित करता है।
CuSO2 + 2NaOH → Cu(OH)2+Na2SO4
प्रश्न 11.
क्या कारण है कि गलित कैल्सियम हाइड्राइड का वैद्युत-अपघटन करने पर हाइड्रोजन ऐनोड पर मुक्त होती है ?
उत्तर
गलित कैल्सियम हाइड्राइड का वैद्युत-अपघटन इस प्रकार होता है।
CaH2 ⇌ Ca2+ + 2H–
हाइड्रोजन आयन के ऋणावेशित होने के कारण हाइड्रोजन ऐनोड पर मुक्त होती है।
प्रश्न 12.
कैल्सियम ऑक्साइड या बिना बुझे चूने के विरचन की एक विधि दीजिए।
उत्तर
कैल्सियम ऑक्साइड या बिना बुझा चूना लाइमस्टोन (CaCO3) को घूर्णी भट्ठी में 1070-1270K ताप पर गर्म करके प्राप्त किया जाता है।

प्रश्न 13.
कैल्सियम हाइड्रॉक्साइड या बुझे चूने को बनाने की एक विधि का वर्णन कीजिए।
उत्तर
कैल्सियम हाइड्रॉक्साइड या बुझे चूने को बिना बुझे चूने में जल मिलाकर प्राप्त किया जाता है। । इस प्रक्रिया को चूने का बुझना कहते हैं।
CaO+ H2O → Ca(OH)2
प्रश्न 14.
प्लास्टर ऑफ पेरिस के जमने की रासायनिक अभिक्रिया का समीकरण दीजिए।
उत्तर
प्लास्टर ऑफ पेरिस जमर्कर कड़ा छिद्रयुक्त ठोस बन जाता है, जिसे प्लास्टर ऑफ पेरिस का जमना कहते हैं। वस्तुतः यह अभिक्रिया प्लास्टर ऑफ पेरिस का जिप्सम में परिवर्तन है।
(CasO4) 2 · H2O+ 3H2O → 2(CasO4·2H2O)
प्रश्न 15.
किंलकर क्या है? इससे सीमेण्ट कैसे बनाया जाता है?
उत्तर
सीमेण्ट के कच्चे पदार्थों से बने मिश्रण को सीमेण्ट की भट्ठी में डालकर गर्म करने के बाद छोटी-छोटी गोलियों के रूप में प्राप्त पदार्थ को किंलकर कहते हैं। क्लिकर; डाइकैल्सियम सिलिकेट, ट्राइकैल्सियम सिलिकेट, ट्राइकैल्सियम ऐलुमिनेट तथा टेट्राकैल्सियम ऐलुमिनोफेराइट का मिश्रण है। क्लिकर में 2-3% जिप्सम मिलाकर इसको पीसकर प्रयोग योग्य सीमेण्ट प्राप्त किया जाता है जिसको पोर्टलैण्ड सीमेण्ट कहते हैं।
प्रश्न 16.
सीमेण्ट किंलकर के मुख्य अवयव क्या हैं? इसमें जिप्सम क्यों मिलाया जाता है?
उत्तर
सीमेण्ट किंलकर के मुख्य अवयव निम्नलिखित हैं-
- डाइकैल्सियम सिलिकेट (2CaO.SiO2)
- ट्राइकैल्सियम सिलिकेट (3CaO.SiO2)
- ट्राइकैल्सियम ऐलुमिनेट (3CaO.Al2O3) तथा
- टेट्राकैल्सियम ऐलुमिनोफेराइट (4CaO.Al2O2.Fe2O3)
सीमेण्ट किंलकर जल के प्रति अति सुग्राही होता है जिससे यह नमी और जल के सम्पर्क में आकर जम जाता है। इसकी जमने की क्षमता को शिथिल करने के लिए मन्दक पदार्थ मिलाए जाते हैं। जिप्सम एक मन्दक पदार्थ है, जिसके मिलाने से सीमेण्ट क्लिकर के जमने की क्षेमतो मन्द हो जाती है और अधिक जल के सम्पर्क में आने पर ही यह जमता है।
प्रश्न 17.
सीमेण्ट के प्रयोग में बालू का क्या उपयोग होता है?
उत्तर
सीमेण्ट जल या नमी के प्रति अति सुग्राही है। नमी के कारण इसमें आन्तरिक प्रतिबल उत्पन्न जाता है, जिससे इसमें दरार पड़ जाती है और इसकी क्षमता कम हो जाती है। बालू मिलाने से। सीमेण्ट में आन्तरिक प्रतिबल उत्पन्न नहीं होता, जिससे सीमेण्ट में दरार नहीं पड़ती है।
लघु उत्तरीय प्रश्न
प्रश्न 1.
लीथियम की तरह सोडियम और पोटैशियम जटिल यौगिक क्यों नहीं बनाते?
उत्तर
लीथियम परमाणु त्रिज्या छोटी होने तथा उच्च आवेश घनत्व एवं d ऑर्बिटल की अनुपस्थिति के कारण जटिल यौगिक बनाता है। जबकि सोडियम एवं पोटैशियम आकार बड़ा होने एवं आवेश घनत्व अपेक्षाकृत निम्न होने के कारण जटिल यौगिक नहीं बनाते हैं।
प्रश्न 2.
क्षार धातुओं की रासायनिक अभिक्रियाशीलता का वर्णन कीजिए।
उत्तर
क्षार धातुएँ बहुत अभिक्रियाशील तत्व हैं, क्योंकि इन धातुओं की ऊर्ध्वपातन ऊष्माएँ (heat of sublimation).और इनके आयनन विभव (l1) बहुत नीचे हैं। इनकी सक्रियता आयनन विभव घटने के साथ बढ़ती है(Li→ Cs)। वायु में रखने पर क्षार धातुओं की धात्विक चमक (metallic lustre) शीघ्रता से मलिन (tarmish) हो जाती है, क्योंकि धातु की सतह पर धातु ऑक्साइड की परत (film) जम जाती है। वायु एवं जल द्वारा सुगमता से ऑक्सीकृत हो जाने के कारण क्षार धातुओं को मिट्टी के तेल में रखते हैं। क्षार धातु (M) अधिकांश अधातुओं के साथ सीधी अभिक्रिया करते हैं। नाइट्रोजन के साथ केवल लीथियम सीधे अभिक्रिया करता है।
लीथियम को ऑक्सीजन के साथ 200°C पर गर्म करने पर लीथियम मोनॉक्साइड, Li2O, बनता है। लीथियम केवल मोनॉक्साइड बनाता है। सोडियम, पोटैशियम व उच्च परमाणु क्रमांक के अन्य क्षार धातु ऑक्सीजन के साथ बहुत शीघ्रता से अभिक्रिया करते हैं। ये धातु वायु या ऑक्सीजन में जलते हैं। सोडियम Na2O और Na2O2(सोडियम परॉक्साइड) का मिश्रण बनाता है। सोडियम धातु को शुष्क शुद्ध ऑक्सीजन गैस की धारा में 300°C पर गर्म करने पर हल्के पीले रंग का ठोस सोडियम परॉक्साइड बनता है।

सोडियम परॉक्साइड पोटैशियम व उच्च परमाणु क्रमांक के अन्य क्षार धातु आयनिक परॉक्साइड (जैसे—K2O2) और सुपरऑक्साइड (जैसे-KO2) बनाते हैं। आयनिक परॉक्साइडों में परॉक्साइड आयन O2-2 और सुपरऑक्साइडों में सुपरऑक्साइड आयन O–2 होता है। क्षार धातु क्लोरीन व अन्य हैलोजनों के साथ सीधे संयोग करते हैं। ये हाइड्रोजन के साथ उच्च ताप पर अभिक्रिया करते हैं। क्षार धातु जल के साथ बहुत तीव्रता (violently) से अभिक्रिया करते हैं। अभिक्रिया में हाइड्रोजन गैस उत्पन्न होती है।
2M + 2H2O → 2MOH + H2
इस अभिक्रिया से उत्पन्न ऊष्मा से क्षार धातु पिघल जाता है और हाइड्रोजन के प्रज्वलित हो जाने से ज्वाला उत्पन्न होती है। रूबिडियम (Rb) और सीजियम (Cs) विस्फोट के साथ अभिक्रिया करते हैं। क्षार धातु (M) अम्लों के साथ तीव्रता से अभिक्रिया करते हैं। अभिक्रिया में हाइड्रोजन मुक्त होती है।
2M + H2SO4 → M2SO4 + H2
क्षार धातु ऐल्कोहॉल से हाइड्रोजन विस्थापित करते हैं-

क्षार धातु कई धातुओं के ऑक्साइडों और क्लोराइडों को धातु में अपचयन करते हैं।
BeCl2 + 2Na → Be + 2NaCl
सोडियम धातु कार्बन डाइऑक्साइड गैस में जलता है और उसे कार्बन में अपचयित कर देता है।
3CO2 + 4Na → 2Na2CO3 + C
प्रश्न 3.
लीथियम के असंगत गुणों का वर्णन कीजिए।
उत्तर
आवर्त सारणी के प्रत्येक वर्ग का प्रथम तत्व वर्ग के अन्य तत्वों से गुणों में भिन्नता प्रदर्शित करता है। यह तत्व का असंगत व्यवहार (anomalous behaviour) कहलाता है। वर्ग के प्रथम तत्व की परमाणु एवं आयनिक त्रिज्या वर्ग के अन्य तत्वों के अपेक्षाकृत बहुत छोटी होने के कारण तत्व असंगत व्यवहार प्रदर्शित करता है।
वर्ग 1 का प्रथम तत्व लीथियम (Li) वर्ग के अन्य तत्वों से गुणों में भिन्नता प्रदर्शित करता है। लीथियम का असंगत व्यवहार लीथियम आयन, Li+ की बहुत छोटी त्रिज्या और उच्च आवेश घनत्व के कारण हैं।
लीथियम के अन्य क्षार धातुओं के गुणों से भिन्न कुछ गुण (असंगत गुण) निम्नलिखित हैं
- क्षार धातुओं में लीथियम (L+ /Li) का मानक इलेक्ट्रोड विभव (मानक अपचयन विभव) असामान्य रूप से उच्च ऋणात्मक है। यह Li+ आयन की बहुत छोटी त्रिज्या और उच्च हाइड्रेशन ऊर्जा के कारण है। जलीय विलयन में लीथियम अन्य क्षार धातुओं से प्रबल
अपचायक है।
- क्षार धातुओं में केवल लीथियम, नाइट्रोजन से अभिक्रिया करता है और लीथियम नाइट्राइट (Li3N) बनाता है। लीथियम और नाइट्रोजन दोनों के परमाणु बहुत छोटे हैं और लीथियम नाइट्राइट की जालक ऊर्जा (lattice energy) उच्च है, इसीलिए लीथियम नाइट्राइट बनता है।
- लीथियम ऑक्सीजन के साथ केवल सामान्य ऑक्साइड, लीथियम मोनॉक्साइड (Li2O) बनाता है। सोडियम मोनॉक्साइड (Na2O) और परॉक्साइड (Na2O2) बनाता है। पोटैशियम मोनॉक्साइड (K2O), परॉक्साइड (Ka2O2) और सुपर ऑक्साइड (KO2) बनाता है। रूबीडियम और सीजियम’ भी मोनॉक्साइड, परॉक्साइड और सुपर ऑक्साइड बनाते हैं। क्षार धातु को ऑक्सीजन के आधिक्य में गर्म करने पर लीथियम का मोनॉक्साइड (Li2O), सोडियम को परॉक्साइड (Na2O2) और पोटैशियम का सुपर ऑक्साइड (KO2) बनता है। रूबीडियम और सीजियम का भी सुपर ऑक्साइड बनता है।
- लीथियम हाइड्रॉक्साइड (LiOH) और लीथियम कार्बोनेट (Li2CO3), जल में अल्प विलेय हैं, जबकि सोडियम, पोटेशियम व अन्य क्षार धातुओं के हाइड्रॉक्साइड और कार्बोनेट जल में पूर्ण विलेय हैं।
- लीथियम बाइकार्बोनेट (LiHCO3) जल में पूर्ण विलेय है जबकि सोडियम, पोटैशियम व अन्य क्षार धातुओं के बाइकार्बोनेट जल में अल्प विलेय हैं।।
- लीथियम कार्बोनेट गर्म करने पर शीघ्रता से अपघटित हो जाता है।
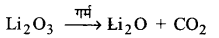
जबकि सोडियम कार्बोनेट, पोटैशियम कार्बोनेट व अन्य क्षार धातुओं के कार्बोनेट बहुत स्थायी हैं। गर्म करने पर बहुत कठिनाई से अति उच्च ताप पर अपघटित होते हैं।
- लीथियम के बड़े, अध्रुवणीय (non-polarizable) ऋणायमों, जैसे-ClO–4 आयन के साथ लवण अन्य क्षार धातुओं के संगत लवणों की अपेक्षा जल में अधिक विलेय होते हैं। यह Li+ आयन की उच्च हाइड्रेशन ऊर्जा के कारण है।
- लीथियम सल्फेट (Li2SO4) फिटकरियाँ (alums) नहीं बनाता है, जबकि अन्य क्षार धातुएँ फिटकरियाँ (alums) बनाती हैं। द्विक सल्फेट (double sulphates) जिनका संघटन M’2SO4.R””2 (SO4)3.24H2O होता है फिटकरियाँ कहलाती हैं, जैसे M’ = NH+4ई या एक संयोजी धातु (जैसे—Na, K आदि) और R’”= त्रि-संयोजी धातु (जैसे-Fe, AI, Cr, Mn
आदि) हैं।
हाइड्रेटेड लीथियम धनायन का आकार बहुत छोटा होने के कारण लीथियम फिटकरी नहीं बनाता है।
- लीथियम नाइट्रेट गर्म करने पर ऑक्साइड में अपघटित हो जाता है।

सोडियम नाइट्रेट और पोटैशियम नाइट्रेट गर्म करने पर नाइट्राइट में अपघटित होते हैं।

- लीथियम फ्लुओराइड जल में अल्प विलेय है जबकि सोडियम, पोटैशियम व अन्य क्षार धातुओं के फ्लुओराइड और जल में विलेय हैं।
लीथियम आयन (Li+) और फ्लुओराइड आयन (F–) दोनों का छोटा आकार होने के कारण . लीथियम फ्लुओराइड की जालक ऊर्जा उच्च है, इसीलिए LiF जल में अल्प विलेय है।
प्रश्न 4.
सोडियम क्लोराइड का निर्माण किस प्रकार किया जाता है। विस्तृत वर्णन कीजिए।
उत्तर
समुद्र, नमक की झीलें और खनिज लवण निक्षेप सोडियम क्लोराइड के मुख्य प्राकृतिक स्रोत हैं जिनसे सोडियम क्लोराइड प्राप्त किया जाता है।
परिस्थितियों के अनुसार, लवण या तो लवण निक्षेपों से खनन द्वारा प्राप्त किया जाता है या लवण संस्तरों से जलीय विलयन ब्राइन (brine) में जल द्वारा निष्कर्षित किया जाता है या समुद्र जल से वाष्पन (evaporation) द्वारा प्राप्त किया जाता है।
नमक युक्त जलीय विलयन का लवण के क्रिस्टलित होने तक सान्द्रण वाष्पन द्वारा किया जाता है। विलयन के सान्द्रण की मुख्य विधियाँ निम्नलिखित हैं-
- खुले कडाहा विधि (Open pan process)
- सौर वाष्पन विधि (Solar evaporation process)
- निर्वात् वाष्पन विधि (Vacuum evaporation process)
लवण निक्षेपों से खनिज ठोस लवण को संदलन के उपरान्त छलनी से छानकर उसका शोधन जल में विलेय करके और विलयन को क्रिस्टलित करके किया जाता है।
कई लवण संस्तरों में, बेधन (boring) करके या कूप (well) खोदकर पाइपों के द्वारा जल प्रवाह करके लवण ब्राइन के रूप में प्राप्त किया जाता है। ब्राइन को पम्प द्वारा बाहर निकालकर विलयन को बहु-प्रभाव उद्वाष्पित्रों (evaporators) में कम दाब पर उद्वाष्पन द्वारा सान्द्रित किया जाता है या विलयन का सान्द्रण उसे उथले (shallow) खुले कडाहों (open pans) में गर्म करके किया जाता है। वायु और सूर्य से उच्छादित (exposed) खुली टंकियों में समुद्र-जल को सान्द्रण वाष्पन द्वारा होता है, जैसे-जैसे ब्राइन सान्द्रित होता है लवण के क्रिस्टल पृथक् होने लगते हैं। क्रिस्टलों को छिद्रित शॉवल द्वारा बाहर निकाल लेते हैं।
उपरोक्त विधियों द्वारा प्राप्त सोडियम क्लोराइड (नमक) में अन्य लवणों, जैसे-कैल्सियम क्लोराइड, मैग्नीशियम क्लोराइड, कैल्सियम सल्फेट और मैग्नीशियम सल्फेट की अल्प मात्राएँ अशुद्धि के रूप में उपस्थित होती है। निर्वात् उद्द्वाष्पन (vacuum evaporation) द्वारा विनिर्मित लवण में लगभग 99.9% सोडियम क्लोराइड उपस्थित होता है। खुले कडाहा (open pan) विधि या सौर वाष्पन (solar evaporation) विधि द्वारा प्राप्त लवण में लगभग 97 से 99% सोडियम क्लोराइड उपस्थित होता है। खनिज, नमक या सेंधा नमक (rock salt) में लगभग 95 से 99% सोडियम क्लोराइड उपस्थित होता है।
प्रश्न 5.
सोडियम बाइकार्बोनेट के विरचन की विधियों एवं उपयोगों का वर्णन कीजिए।
उत्तर
सोडियम बाइकार्बोनेट के विरचन की प्रमुख विधियाँ निम्नलिखित हैं-
- सोडियम कार्बोनेट से-सोडियम कार्बोनेट के ठण्डे सान्द्र विलयन में कार्बन डाइऑक्साड गैस प्रवाहित करने पर सोडियम बाइकार्बोनेट सफेद ठोस के रूप में अवक्षेपित हो जाता है। उसे छानकर अलग कर लेते हैं।
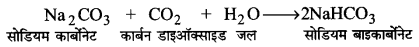
- अमोनिया-सोडा प्रक्रम( सॉल्वे प्रक्रम) द्वारा–सॉल्वे प्रक्रम द्वारा सोडियम कार्बोनेट का निर्माण करने में पहले सोडियम बाइकार्बोनेट बनता है जिसे अपघटित करके सोडियम कार्बोनेट प्राप्त किया जाता है।
सॉल्वे विधि में अमोनिया द्वारा संतृप्त सान्द्र सोडियम क्लोराइड विलयन की कार्बन डाइऑक्साइड गैस से क्रिया कराने पर सोडियम बाइकार्बोनेट अविलेय ठोस के रूप में पृथक् हो जाता है।
NaCl + NH3 + H2O → NaHCO3 + NH2Cl
सोडियम बाइंकार्बोनेट को छानकर अलग कर लेते हैं। गर्म करने पर सोडियम बाइकार्बोनेट, सोडियम कार्बोनेट में अपघटित हो जाता है।
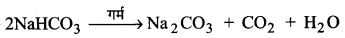
सोडियम कार्बोनेट में अमोनियम लवणों की अशुद्धि होती है। सोडियम कार्बोनेट को जल में घोलकर सान्द्र विलयन में कार्बन डाइऑक्साइड गैस प्रवाहित करते हैं जिससे शुद्ध सोडियम बाइकार्बोनेट अवक्षेपित हो जाता है, उसे छानकर पृथक् कर लेते हैं।

सोडियम बाइकार्बोनेट के प्रमुख उपयोग निम्नलिखित हैं-
- सोडियम बाइकार्बोनेट का उपयोग बेकिंग पाउडर में होता है, इसलिए सोडियम बाइकार्बोनेट बेकिंग सोडा कहलाता है।
- सोडियम बाइकार्बोनेट स्वास्थ्य हितकर लवणों और सेलिट्स पाउडर का महत्वपूर्ण घटक है।
- सोडियम बाइकार्बोनेट का उपयोग अग्निशामकों (fire extinguisheres) में किया जाता है।
- सोडियम बाइकार्बोनेट का उपयोग चर्म उत्पादन में होता है।
- कॉपर, जिंक और लेड के नॉर्मल कार्बोनेट बनाने में।
- चर्म रोगों के लिए मन्द पूर्तिरोधी (antiseptic) के रूप में।
प्रश्न 6.
क्षारीय मृदा धातुओं की रासायनिक अभिक्रियाशीलता का वर्णन कीजिए।
उत्तर
क्षारीय मृदा धातुएँ बहुत अभिक्रियाशील हैं, परन्तु ये क्षार धातुओं से कम क्रियाशील हैं। इनकी सक्रियता धन विद्युत प्रकृति बढ़ने के साथ बढ़ती है (Be → Ra) वायु में रखने पर इनकी धात्विक चमक मलिन हो जाती है, क्योकि धातु की सतह पर ऑक्साइड की परत बन जाती है। इन तत्वों में बेरिलियमें सबसे कम क्रियाशील है। परमाणु त्रिज्या छोटी और ऊर्ध्वपातन ऊर्जा व आयनन ऊर्जा • अपेक्षाकृत ऊँची होने के कारण बेरिलियम अन्य क्षारीय मृदा धातुओं से गुणों में भिन्नता प्रदर्शित करता है।
क्षारीय मृदा धातु (M) ऑक्सीजन के साथ ऑक्साइड (MO), नाइट्रोजन के साथ नाइट्राइड (M3N2), हाइड्रोजन के साथ हाइड्राइड (MH2) और हैलोजनों के साथ हैलाइड (MX2) बनाते हैं। बेरिलियम हाइड्रोजन से सीधी अभिक्रिया नहीं करता है।
बेरिलियम को छोड़कर अन्य सभी क्षारीय मृदा धातु जल से क्रिया करते हैं। मैग्नीशियम उच्च ताप पर जल (भाप) से क्रिया करता है, क्योंकि मैग्नीशियम के पृष्ठ पर ऑक्साइड की परत जमी होती है।
M + 2H2O → M(OH)2 + H2
क्षारीय मृदा धातु (M) अम्लों से हाइड्रोजन विस्थापित करते हैं। बेरिलियम अम्लों और क्षारकों दोनों से हाइड्रोजन विस्थापित करता है।
M + H2SO4 → MSO4 + H2
धातुओं में केवल मैग्नीशियम और मैंगनीज ठण्डे और अति तनु नाइट्रिक अम्ल के साथ हाइड्रोजन गैस (H2) देते हैं।
Mg + 2HNO3 → Mg(NO3)2 + H2
Mn + 2HNO3 → Mn(NO3)2 + H2
प्रश्न 7.
बेरिलियम के असंगत गुणों का वर्णन कीजिए।
उत्तर
बेरिलियम की परमाणु और आयनिक त्रिज्याएँ अन्य क्षारीय मृदा धातुओं की त्रिज्याओं के अपेक्षाकृत बहुत छोटी होने के कारण बेरिलियम अन्य क्षारीय मृदा धातुओं से गुणों में भिन्नता प्रदर्शित करता है। बेरिलियम के कुछ असंगत गुण (anomalous properties) निम्नलिखित हैं-
- बेरिलियम जल से अभिक्रिया नहीं करता है। अन्य सभी क्षारीय मृदा धातुएँ जल से अभिक्रिया करती हैं।
- बेरिलियम हाइड्रोजन से सीधी अभिक्रिया नहीं करता है। अन्य क्षारीय मृदा धातुएँ हाइड्रोजन से सीधी अभिक्रिया करती हैं।
- बेरिलियम उभयधर्मी (amphoteric) धातु है। बेरिलियम प्रबल क्षारों और अम्लों दोनों के विलयनों से अभिक्रिया करता है और हाइड्रोजन विस्थापित करता है। अन्य क्षारीय मृदा धातुएँ केवल अम्लों से अभिक्रिया करती हैं।
Be + 2NaOH + 2H2O → Na2[Be(OH)4] + H2
Be + H2SO4 → BeSO4 + H2
- बेरिलियम आयन, Be2+, का आवेश/त्रिज्या अनुपात उच्च होने के कारण बेरिलियम की ध्रुवण क्षमता (polarising Power) अन्य क्षारीय मृदा धातु आयनों की अपेक्षा उच्च होती है, अत: बेरिलियम की सहसंयोजक बन्ध बनाने की प्रवृत्ति अपेक्षाकृत अधिक होती है। बेरिलियम के यौगिकों में सहसंयोजक लक्षण की प्रधानता होती है। अन्य क्षारीय मृदा धातुओं के यौगिक मुख्यत: आयनिक होते हैं।
- बेरिलियम फ्लुओराइड जल में पूर्ण विलेय है। बेरिलियम फ्लुओराइड की जल में विलेयता बेरिलियम आयन की उच्च हाइड्रेशन ऊर्जा के कारण है। अन्य क्षारीय मृदा धातुओं के फ्लुओराइड जल में अल्प विलेय हैं।
- बेरिलियम ऑक्साइड सहसंयोजक यौगिक है। यह जल के साथ अभिक्रिया नहीं करता है। अन्य क्षारीय मृदा धातुओं के ऑक्साइड आयनिक यौगिक हैं और जल के साथ अभिक्रिया करके हाइड्रॉक्साइड बनाते हैं।
- बेरिलियम ऑक्साइड (BeO) उभयधर्मी (amphoteric) ऑक्साइड है। यह अम्ल और क्षार दोनों के विलयनों के साथ अभिक्रिया करता है। अन्य क्षारीय मृदा धातुओं के ऑक्साइड क्षारीय हैं।
Be0 + 2NaOH + H2O → Na2 [Be(OH)4]
BeO + H2SO4 → BeSO4 + H2O
- बेरिलियम हाइड्रॉक्साइड [Be(OH)4] उभयधर्मी है। यह अम्ल और क्षारों दोनों के साथ अभिक्रिया करता है। अन्य क्षारीय मृदा धातुओं के हाइड्रॉक्साइड प्रबल क्षार हैं।
Be(OH)2 + 2NaOH → Na2[Be(OH)4]
Be(OH)2 + H2SO4 → BeSO4 + 2H2O
- बेरिलियम हाइड्रॉक्साइड और मैग्नीशियम हाइड्रॉक्साइड जल में अविलेय हैं। अन्य क्षारीय मृदा धातुओं के हाइड्रॉक्साइड जल में विलेय हैं।
- बेरिलियम सल्फेट और मैग्नीशियम सल्फेट जल में विलेय हैं, परन्तु अन्य क्षारीय मृदा धातुओं के सल्फेट जल में अविलेय हैं।
- बेरिलियम की अन्य क्षारीय मृदा धातुओं के अपेक्षाकृत संकर यौगिक बनाने की प्रबल प्रवृत्ति है। बेरिलियम फ्लुओराइड आयनों के साथ संकर यौगिक, Na2[BeF4], सोडियम टेट्राफ्लुओरोबेरिलेट बनाता है।
ऐसीटिक अम्ल की बेरिलियम हाइड्रॉक्साइड से क्रिया कराने पर बेसिक बेरिलियम ऐसीटेट, Bea0 (CHCOO) बनता है। यह सहसंयोजक यौगिक है। इसका गलनांक और क्वथनांक नीचा है और ये बिना अपघटित हुए सिवित हो जाता है। अन्य क्षारीय मृदा सहसंयोजक बेसिक ऐसीटेट नहीं बनाती हैं।
- बेरिलियम क्लोराइड (BeCl2) सहसंयोजन वाष्पशील यौगिक है। यह जल-अपघटित हो जाता है। अन्य क्षारीय मृदा धातुओं के क्लोराइड आयनिक यौगिक हैं जो जल-अपघटित नहीं होते हैं।
BeCl2 + 2H2O → Be(OH)2 + 2HCl
प्रश्न 8.
चूने के कोई चार औद्योगिक उपयोग लिखिए।
उत्तर
चूने के उपयोग निम्नलिखित हैं
- बिल्डिग सामग्री के निर्माण में।
- पोर्टलैण्ड सीमेन्ट बनाने में।
- आयरन के निष्कर्षण में गालक के रूप में।
- जल की अस्थायी कठोरता को दूर करने में।
- बुझा चूना, बिना बुझा चूना, दूधिया चूना आदि के निर्माण में।
प्रश्न 9.
प्लास्टर ऑफ पेरिस के विरचन की विधि, गुण एवं उपयोगों का वर्णन कीजिए।
उत्तर
प्लास्टर ऑफ पेरिस (CaSO4·[latex]\frac { 1 }{ 2 } [/latex]H2O या 2CaSO4 ·H2O) कैल्सियम सल्फेट हेमी हाइड्रेट, CaSO4·[latex]\frac { 1 }{ 2 } [/latex]H2O को प्लास्टर ऑफ पेरिस कहते हैं। इसे प्रायः 2CaSO4 ·H2O सूत्र द्वारा प्रदर्शित करते हैं।
प्लास्टर ऑफ पेरिस बनाने की विधि
जिप्सम (gypsum) को 150-169°C पर गर्म करने से प्लास्टर ऑफ पेरिस बनता है।

प्लास्टर ऑफ पेरिस के गुण
1. प्लास्टर ऑफ पेरिस सफेद रंग का चूर्ण है जो तेज गर्म करने पर पहले निर्जल CaSO4 के 7-रूप में फिर γ-रूप में बदल जाता है।

बहुत उच्च ताप (1100°C) पर गर्म करने पर निर्जल कैल्सियम-सल्फेट, कैल्सियम ऑक्साइड और सल्फर ट्राइऑक्साइड में अपघटित हो जाता है।
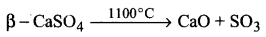
2. प्लास्टर ऑफ पेरिस की जल से क्रिया कराने पर ऊष्मा उत्पन्न होती है और वह जल अवशोषित करके शीघ्रता से जिप्सम में बदलकर, जम जाता है। इस क्रिया को प्लास्टर ऑफ पेरिस का जमना (setting) कहते हैं।

प्लास्टर ऑफ पेरिस के उपयोग
- टूटी हुई हड्डियों का प्लास्टर करने में।
- साँचे और मॉडल बनाने में।
- मूर्तियाँ, खिलौने एवं अन्य सजावटी वस्तुएँ बनाने में।
विस्तृत उत्तरीय प्रश्न
प्रश्न 1.
आवर्त सारणी में क्षार धातुओं की स्थिति 1A समूह में इलेक्ट्रॉनिक विन्यास के आधार पर समझाइए।
या
इलेक्ट्रॉनिक विन्यास के आधार पर आवर्त सारणी के क्षार धातुओं (Li, Na, K) की स्थिति की विवेचना कीजिए।
उत्तर
इलेक्ट्रॉनिक विन्यास–सोडियम तथा पोटैशियम आवर्त सारणी के IA समूह में रूबीडियम, सीजियम व फ्रैंसियम के साथ स्थित हैं। इस उप-समूह की धातुओं को क्षार धातुएँ कहते हैं, क्योंकि इनके हाइड्रॉक्साइड जल में घुलकर क्षारीय विलयन बनाते हैं। इनका इलेक्ट्रॉनिक विन्यास इस प्रकार है।
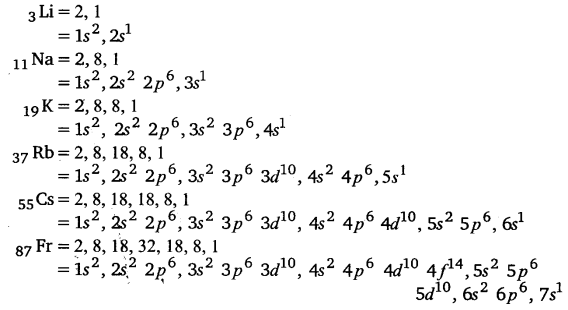
इन तत्त्वों के भीतरी कोश का विन्यास अक्रिय गैस के समान है। समान इलेक्ट्रॉनिक विन्यास होने के कारण ये तत्त्व समान गुण प्रदर्शित करते हैं। अतः इन्हें एक ही उप-समूह में रखा जाना उचित है।
गुणों में समानता
- सभी चाँदी के समान सफेद तथा नर्म धातुएँ हैं।
- इनकी ऑक्सीकरण संख्या + 1 है।।
- ये वैद्युत तथा ऊष्मा के सुचालक हैं।
- वायु या ऑक्सीजन में गर्म करने पर सामान्य ऑक्साइड बनाते हैं तथा वायु या ऑक्सीजन में जलाने पर परॉक्साइड बनाते हैं।
4Na + O2 → 2Na2O; 4K + O2 2K2O
2Na + O2 → Na2O2; 2K + O2→ K2O2
- शुष्क हाइड्रोजन के साथ गर्म करने पर हाइड्राइड बनाते हैं।
2Na + H2 → 2NaH; 2K + H2 → 2KH
- ये हैलोजन से क्रिया करके हैलाइड बनाते हैं।
2Na + Cl2 → 2NaCl; 2K + Cl2 → 2KCl
- जल तथा ऐल्कोहॉल के साथ क्रिया करके हाइड्रोजन निकालते हैं।
2Na + 2H2O → 2NaOH + H2 ↑

भौतिक गुणों का श्रेणीकरण
- परमाणु क्रमांक बढ़ने पर क्षार धातुओं की कठोरता कम होती है।
- इनके गलनांक, क्वथनांक तथा विशिष्ट ऊष्मा परमाणु क्रमांक की वृद्धि के साथ घटते हैं।
- परमाणु क्रमांक की वृद्धि के साथ इनकी क्रियाशीलता बढ़ती है।
- परमाणु आयतन तथा आपेक्षिक घनत्व परमाणु क्रमांक की वृद्धि के साथ बढ़ते हैं।
- परमाणु क्रमांक बढ़ने पर बाइकार्बोनेटों का अपघटन घटता है।
रासायनिक गुणों की समानता एवं भौतिक गुणों के श्रेणीबद्ध परिवर्तन के अध्ययन से इन तत्त्वों की आवर्त सारणी में एक ही उपवर्ग में स्थित होने की पुष्टि होती है।
प्रश्न 2.
कास्टनर-कैलनर सेल विधि द्वारा कास्टिक सोडा का निर्माण किस प्रकार किया जाता है? सचित्र वर्णन कीजिए। इसके दो उपयोग लिखिए।
उत्तर
कास्टनर-कैलनर सेल में स्लेट का बना हुआ एक टैंक होता है, जो स्लेट के विभाजकों द्वारा तीन भागों में बँटा रहता है। स्लेट के विभाजक पारे (Hg) से ढकी हुई टैंक की तली को स्पर्श करते हैं। टैंक के बाएँ तथा दाएँ कक्षों में NaCl का सान्द्र विलयन (ब्राइन) भरा जाता है तथा इन कक्षों में ग्रेफाइट ऐनोड लगे रहते हैं। बीच के कक्ष में जल भरा रहता है तथा लोहे की छड़ों का कैथोड लगा रहता है।
विद्युत धारा प्रवाहित करने पर, दाएँ तथा बाएँ कक्षों में ग्रेफाइट ऐनोड पर क्लोरीन मुक्त होती है। मर्करी कैथोड पर सोडियम अमलगम बनता है।
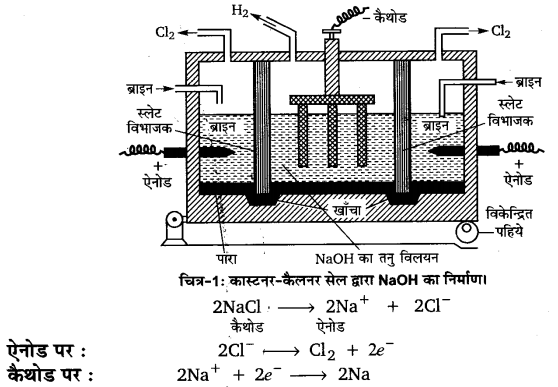
इस इलेक्ट्रोड पर Hg सोडियम से क्रिया करके अमलगम बनाती है।

सोडियम अमलगम सेल के बाएँ कक्ष के नीचे लगे विकेन्द्रित पहिये को घुमाकर सेल को इधर-उधर हिलाया जाता है। इस प्रकार, सोडियम-अमलेगम दाएँ वे बाएँ कक्षों से बीच के कक्ष में कर लेते हैं।
इसमें Na-Hg जल से क्रिया करके NaOH का निर्माण करता है और H, गैस मुक्त होती है। Hg को , छानकर पृथक् कर देते हैं।
2(Na-Hg) + 2H2O → 2NaOH + 2Hg ↓ + H2 ↑
सोडियम हाइड्रॉक्साइड विलयन का वाष्पन करने से ठोस सोडियम हाइड्रॉक्साइड प्राप्त कर लेते हैं।
गन्धक के साथ क्रिया-हाइपो प्राप्त होता है।

उपयोग-
- साबुन बनाने में।
- प्रयोगशाला में अभिकर्मक के रूप में।
We hope the UP Board Solutions for Class 11 Chemistry Chapter 10 The s-block Elements (s-ब्लॉक तत्त्व) help you. If you have any query regarding UP Board Solutions for Class 11 Chemistry Chapter 10 The s-block Elements (s-ब्लॉक तत्त्व), drop a comment below and we will get back to you at the earliest.